
【题目】某第三周期元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为( )
A. H2XO3 B. HXO3 C. H3XO4 D. H2XO4
科目:高中化学 来源: 题型:
【题目】计算后填空:
(1)在标准状况下,448 mL某气体的质量为0.64 g,这种气体的相对分子质量为________。
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2 mol·L-1,c(Cl-)=1 mol·L-1。则c(Na+)为________。
(3)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(4)500mL Fe2(SO4)3溶液中含Fe3+ 28 g,则溶液中SO42-的物质的量浓度为________mol·L-1。
(5)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL1mol/L盐酸 ②改用30mL6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度
A. ①②④ B. ②③④ C. ①③④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al2O3和SiO2的混合物经过下列流程处理,可以回收其中的铝元素。

试计算:
(1)若铝元素全部转化为铝单质,则Al2O3在原混合物中的质量分数为多少______?
(2)若盐酸恰好溶解其中的Al2O3,则盐酸的物质的量浓度为多少mol/L______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。
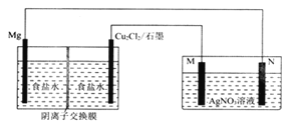
下列说法正确的是
A. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
B. M电极材料为铜片
C. 接通电路后,电池的正极质量减小
D. 接通电路后,AgNO3溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示为下图所示
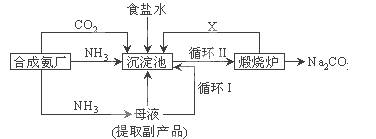
(1)侯氏制碱法又称___________,副产品的一种用途为____________ .
(2)写出上述流程中 X 物质的分子式________。
(3)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水中,再滴加_________。
(4)请简述与索尔维法相比,侯氏制碱法的优点:____。
(5)如图是在实验室中模拟“氨碱法”制取 NaHCO3 的部分装置。
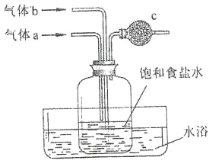
完成下列填空:
仔细观察两只通气导管内所处的位置,由此推断:
气体 a 为_____,气体 b 为_________;两者的通入次序为_____。 为防止尾气污染,c 中可放入蘸_____溶液的脱脂棉。
(6)气体 a 与 b 均可用如图装置进行制备。 当锥形瓶中固体为生石灰时,分液漏斗中应盛放_________。 用该装置制备另一种气体的方法是:_____(用离子方程式表示)。
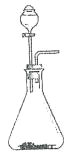
(7)反应过程中可以看到装置饱和食盐水中有晶体逐渐析出,写出相关反应的化学方程式:________。
(8)反应过程中采用水浴加热,其优势是_____。
水浴温度维持在 42℃左右,温度过低,反应速率太慢,不利于晶体析出;温度过高,_____,也不利于晶体析出。
(9)反应结束后,将热水浴换成冰水浴,冷却 15min 左右再进行过滤,目的是:_________。
(10)得到的 NaHCO3 晶体中会含有少量 NaCl 杂质,可采用如下方法进行纯度测定:
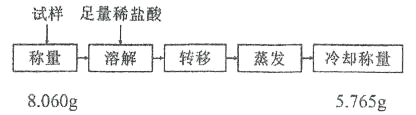
该试样中 NaHCO3 的质量分数为_____(精确到 0.01)。若称量操作无误,但最终测定结果的相对误差为 1.5%,写出可能导致该结果的一种情况:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列气体:①N2、②O2、③NO2、④NO、⑤CO2、⑥CO,其中属于大气污染物的是( )
A.③④⑥B.①②③④C.③④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用AZX表示原子:
(1)中性原子的中子数:N=_________。
(2)阳离子AXn+共有x个中子,则电子数=_________。
(3)AX2原子核外有x个电子,则n g AX2所含中子的物质的量为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com