
【题目】下列图示与对应的叙述不相符合的是( )
A.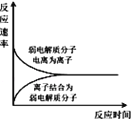 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程
B.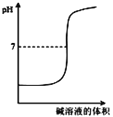 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线
C.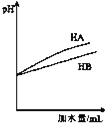 表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D.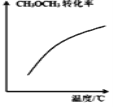 表示密闭容器中
表示密闭容器中![]() 达到平衡后,恒压升高温度过程中,
达到平衡后,恒压升高温度过程中,![]() 的转化率变化趋势
的转化率变化趋势
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是
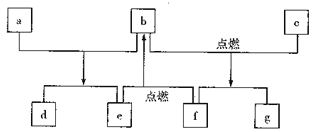
A. 简单离子的半径:Y>Z>X B. 元素的非金属性:W>X
C. 最高价氧化物对应水化物的碱性:Y>Z D. X、Y两种元素组成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)为原料制取红矾钠 (Na2Cr2O7·2H2O)的流程如图所示。
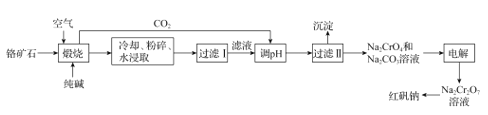
已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅烧”时,Cr2O3参加反应的化学方程式为_____。若“煅烧”操作最适宜的温度是800~900℃,则在实验室中进行此项操作时,应选择_____坩埚(填字母)。
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有_____(填化学式)。
(3)“过滤II”所得沉淀主要有______(填化学式)。
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有_____,经洗涤、干燥得到红矾钠样品。
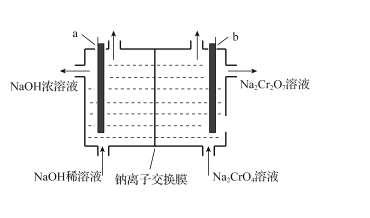
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为____。若初始加入电解池中的c (Na2CrO4)=1.0mol·L-l,随着“电解”的进行,当溶液pH=6时,Na2CrO4的转化率为______(忽略电解过程中溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米小人”(NanoPutians”)是莱斯大学的StephanieH.Chanteau和JamesM.Tour创造出来的小家伙。他们不仅设计出了一系列2nm大小的迷你小人分子,而且还真的把它们合成了出来。如图是其中的一种,下列说法正确的是( )
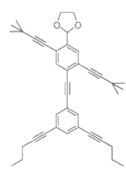
A.如图“纳米小人”含苯环,属于芳香烃
B.如图“纳米小人”所有碳原子可能共平面
C.如图“纳米小人”含有三种官能团
D.如图“纳米小人”能发生加成反应、取代反应、氧化反应、还原反应等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
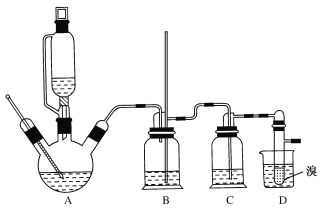
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 以可逆反应为原理的原电池发生反应达平衡时,该电池仍有电流产生
B. 向AgCl、AgBr的饱和溶液中加入少量的AgNO3,溶液中氯离子和溴离子浓度的比值不变
C. 使用催化剂能够降低反应的△H
D. 金属发生吸氧腐蚀时,被腐蚀的速率和氧浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是一种消毒防腐剂,其钠盐可抑制牙膏中微生物的生长。甲苯氧化法是实验室制备苯甲酸的常用方法之一。
(一)反应原理
C6H5CH3+2KMnO4![]() C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+HCl→C6H5COOH+KCl
已知:苯甲酸相对分子质量122,熔点122.4℃;苯甲酸在水中的溶解度如下表。
温度/℃ | 17.5 | 25 | 75 | 80 | 100 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 |
(二)实验过程
①将一定量甲苯、水、几粒沸石加入三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入适量高锰酸钾,搅拌回流反应4小时;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图1)、洗涤、干燥得苯甲酸粗产品。
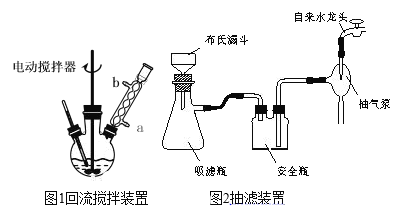
(1)图1电动搅拌器的作用是_____,冷凝管中冷水应从_____(填“a”或“b”)口进入;判断甲苯被氧化完全的实验现象是____。
(2)第③步抽滤操作时,要趁热进行,是因为_____,反应混合物趁热减压过滤后,若溶液呈红色,可用少量NaHSO3溶液处理,反应的离子方程式为_____。
(三)纯度测定
(3)称取1.22g产品溶解在甲醇中配成100mL溶液,移取25.00mL溶液,用KOH标准溶液进行滴定,消耗KOH的物质的量为2.30×10-3mol,产品中苯甲酸质量百分数为____(保留两位有效数字)。
(四)实验反思
(4)得到的粗产品要进一步提纯苯甲酸,可采用_____的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定化学用语正确的是( )
A. NaHCO3水解的离子方程式:HCO3-+H2O = CO32-+H3O+
B. Ba(OH)2的电离方程式:Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C. NaHSO4在水中的电离方程式:NaHSO4= Na++H++SO42-
D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(2)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 配位键 E 范德华力
(3)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ_________g·cm-3。
,该晶体的密度ρ_________g·cm-3。
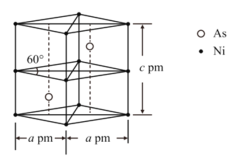 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com