
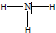 .
.分析 甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L H2,则甲中含有H元素,甲与水反应能产生H2,同时产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,应为Al(OH)3,综上可知,甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3;
乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g/L,则丙的相对原子质量为1.25g•L-1×22.4L=28,则丙为N2,则乙为NH3,据此解答.
解答 解:甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L H2,则甲中含有H元素,甲与水反应能产生H2,同时产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,应为Al(OH)3,综上可知,甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3;
乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g/L,则丙的相对原子质量为1.25g•L-1×22.4L=28,则丙为N2,则乙为NH3.
(1)乙为氨气,结构式是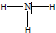 ,故答案为:
,故答案为: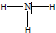 ;
;
(2)甲与水反应的化学方程式是:AlH3+3H2O=Al(OH)3+3H2↑,故答案为:AlH3+3H2O=Al(OH)3+3H2↑;
(3)气体丙与金属镁反应的产物的化学式是:Mg3N2,故答案为:Mg3N2;
(4)乙在加热条件下与CuO 反应可生成Cu和气体丙,该反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2↑,故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2↑.
点评 本题考查无机物的推断,属于计算型推断,注意根据反应的现象以及数据判断甲两种物质,侧重考查学生对知识的迁移应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
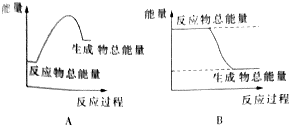
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
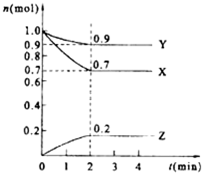 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 2Z;
2Z;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的氧化物一定能溶于水 | |
| B. | R的最高价氧化物对应水化物是H2RO3 | |
| C. | R的氢化物的水溶液呈碱性 | |
| D. | R的氧化物都能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 制乙炔时用饱和食盐水代替水 | 加快化学反应速率 |
| B | CH4与SO2混合气体通过盛有溴水的洗气瓶 | 除去中CH4的SO2 |
| C | 甲烷与乙烯的混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去甲烷中的乙烯 |
| D | 将浓硫酸、乙醇混合加入试管中,加热,然后将导管末端插入酸性KMnO4溶液中,观察现象; | 检验是否有乙烯生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 39K+和40Ca2+微粒中的电子数和中子数都相等 | |
| B. | D2和He在同温同压时,若体积相等,则质量相等 | |
| C. | 同一元素的各种同位素的物理性质、化学性质均不相同 | |
| D. | 两个质量数和电子数都相等的微粒不一定是同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
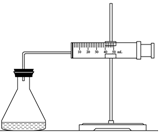 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com