
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
分析 解:A.硫化亚铁溶于稀硝酸中时,因硝酸具有强氧化性,可以将亚铁离子氧化为三价,也会将硫化氢氧化,所以产物中不会生成Fe2+和H2S;
B.含等物质的量的KHCO3和Ba(OH)2溶液混合,钡离子和碳酸氢根按物质的量之比1:1反应,离子方程式按照碳酸氢钾的化学式组成书写;
C.二氧化碳少量,反应生成碳酸根离子;
D.硫离子的水解分步进行,主要以第一步为主,其水解的离子方程式写出第一步水解即可.
解答 解:A.稀硝酸能够将亚铁离子和硫离子氧化,正确的离子方程式为:NO3-+FeS+4H+=Fe3++S+NO↑+2H2O,故A错误.
B.含等物质的量的KHCO3和Ba(OH)2溶液混合,钡离子和碳酸氢根按物质的量之比1:1反应,反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,故B正确;
C.少量CO2通入硅酸钠溶液中,反应生成碳酸根离子,正确的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-,故C错误;
D.硫化钠中的硫离子是多元弱酸根离子,分步水解,以第一步为主,正确的水解离子方程式为:S2-+H2O?HS-+OH-,故D错误;
故选B.
点评 本题考查了离子方程式书写判断,题目难度中等,注意掌握离子方程式的书写原则,试题侧重考查反应物过量对生成物的影响,D为易错点,注意多元弱酸根离子的水解分步进行.


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
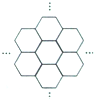 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )| A. | 碳膜片属于碳元素的同素异形体 | |
| B. | 碳膜片与C60是同一种物质 | |
| C. | 碳膜片属于人工合成的有机高分子材料 | |
| D. | 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
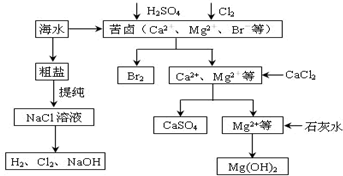

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
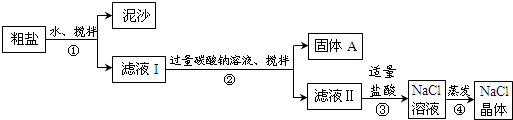
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ①有气泡冒出且澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入②稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ③猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, ④加入硝酸酸化的硝酸钡溶液 | ⑤产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol•L-1的KClO3溶液中,K+的个数为NA | |
| B. | 在标准状况下,22.4 L CH3CH2OH的分子数为NA | |
| C. | 32 g氧气和臭氧的混和气体中含有的氧原子数为2NA | |
| D. | 22.4 L HCl气体中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在氧气中燃烧 | B. | 铁粉与高温水蒸气反应 | ||
| C. | 碳酸氢铵受热分解 | D. | Na2O2加入氯化铵溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com