
【题目】K2Cr2O7是一种强氧化剂,在酸性条件下与乙醇发生如下反应: 3CH3CH2OH+2K2Cr2O7+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(1)Cr基态核外电子排布式为________。
(2)K、S、O三种元素的第一电离能由大到小的顺序为________。
(3)乙醇的沸点比甲醚(CH3OCH3)的高,主要原因是________。与H2O空间结构相同的一种阴离子为________(填化学式)。
(4)[Cr(H2O)5Cl]Cl2·H2O是铬(Ⅲ)的一种配合物,1 mol [Cr(H2O)5Cl]2+中含有σ键的数目为________。
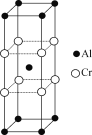
(5)某铬铝合金是一种轻质高温材料,其晶胞结构如图所示,该晶体中n(Cr)∶n(Al)=________。
【答案】1s22s22p63s23p63d54s1或[Ar]3d54s1 O>S>K 乙醇分子间存在氢键 NH2- 16×6.02×1023个或16NA 1∶1
【解析】
(1)Cr是24号元素,根据构造原理及原子核外电子处于全满、半满或全空时是稳定结构分析;
(2)元素的金属性越强,其第一电离能越小;元素的非金属性越强,其第一电离能越大分析;
(3)根据乙醇属于分子晶体,分子之间存在氢键分析判断;结合等电子体结构相似,性质相似分析;
(4)在该离子中含有两种配位体,配位体与中心离子之间通过配位键结合,再分析H2O中含有的共价键进行计算;
(5)用均摊法计算一个晶胞中含有的Cr、Al数目,然后计算二者的物质的量的比。
(1)Cr是24号元素,根据构造原理及原子核外电子排布规律可知基态核外电子排布式为1s22s22p63s23p63d54s1或写为[Ar]3d54s1;
(2)K是金属元素,O、S是非金属元素,元素的非金属性O>S>K,由于元素的金属性越强,其第一电离能越小;元素的非金属性越强,其第一电离能越大,所以这三种元素的第一电离能由大到小的顺序为O>S>K;
(3)乙醇和甲醚都是由分子通过分子间作用力构成的分子晶体,由于乙醇分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的相互吸引力,使乙醇的沸点比其同分异构体甲醚(CH3OCH3)的高;H2O是V形分子,由于等电子体结构相似,性质也相似,则与H2O空间结构相同的一种阴离子为NH2-;
(4)络离子[Cr(H2O)5Cl]Cl2·H2O是铬(Ⅲ)的一种配合物,在1个[Cr(H2O)5Cl]2+中,中心离子Cr3+与5个H2O、1个Cl-通过6个配位键结合,配位键都是共价单键,属于σ键;在1和H2O中含有2个C-H共价键,属于σ键,所以1 个 [Cr(H2O)5Cl]2+中含有σ键的数目为6+5×2=16个,则在1 mol [Cr(H2O)5Cl]2+中含有σ键的数目为16NA;
(5)根据晶胞结构可知Al原子在晶胞8个顶点上和晶胞体内,因此含有的Al原子数目为1+![]() ×8=2;Cr原子有8个,位于晶胞的棱边上,则含有的Cr原子数目为:
×8=2;Cr原子有8个,位于晶胞的棱边上,则含有的Cr原子数目为:![]() ×8=2,所以该晶体中n(Cr)∶n(Al)=2:2=1:1。
×8=2,所以该晶体中n(Cr)∶n(Al)=2:2=1:1。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是
A.①和②中发生的反应均为复分解反应
B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C.一段时间后②中有胶冻状物质生成
D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
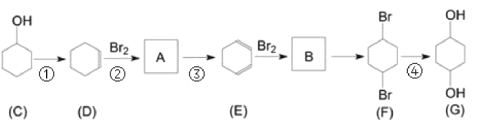
【题目】有机物G(1,4-环己二醇)是重要的医药中间体和新材料单体,可通过以下流程制备。
完成下列填空:
(1)写出C中含氧官能团名称_____________。
(2)判断反应类型:反应①________;反应②_______。
(3)写出B的结构简式_______________。
(4)写出反应③的化学方程式_________。
(5)一定条件下D脱氢反应得一种产物,化学性质稳定,易取代、难加成。该产物属于____(填有机物类别),说明该物质中碳碳键的特点________________________。
(6)写出G与对苯二甲酸在一定条件下反应生成高分子物质的化学方程式_____________。
(7)1,3-丁二烯是应用广泛的有机化工原料,它是合成D的原料之一,它还可以用来合成氯丁橡胶(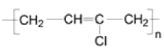 ).写出以1,3-丁二烯为原料制备氯丁橡胶的合成路线。(合成路线常用的表示方式为:A
).写出以1,3-丁二烯为原料制备氯丁橡胶的合成路线。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_______________
目标产物)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
B.2 molCO的摩尔质量和1 mol CO的摩尔质量
C.64 g二氧化硫中氧原子数和标准状况下22.4 LCO中氧原子数
D.20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究金属腐蚀的条件和速率,某课外兴趣活动小组学生用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是
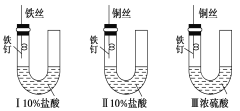
A.实验结束时,装置Ⅰ左侧的液面会下降
B.实验结束时,左侧液面装置Ⅰ比装置Ⅱ的低
C.实验结束时,装置Ⅱ中的铁钉腐蚀最严重
D.实验结束时,装置Ⅲ中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种药物中间体,可以通过以下方法合成:
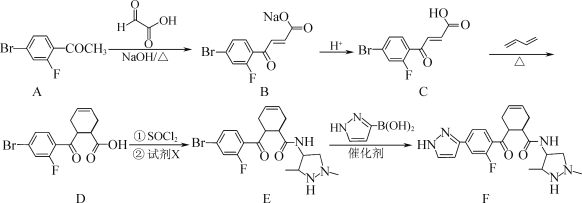
(1)C中的含氧官能团名称为________和________。
(2)E![]() F的反应类型为________。
F的反应类型为________。
(3)试剂X的分子式为C5H13N3,写出X的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;② 分子中只有4种不同化学环境的氢。
(5)写出以CH3CH=CHCH3、HCHO及CH3COCH3为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是
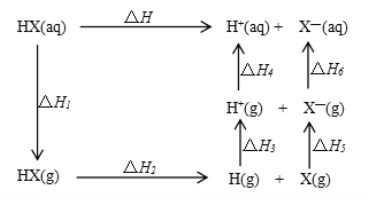
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法在我国工业发展中具有重要作用。现某学习小组在实验室中利用下列反应装置模拟侯氏制碱法制备 NaHCO3,反应原理为 NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。下列说法正确的是
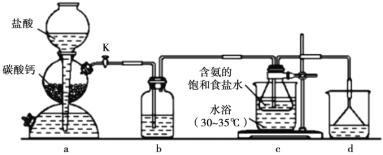
A.装置 a 中可改用碳酸钙粉末提高反应速率
B.装置 b、d 依次盛装饱和 Na2CO3 溶液、稀硫酸
C.装置 c 中含氨的饱和食盐水提高了 CO2 吸收效率
D.反应后将装置 c 中的锥形瓶充分冷却,蒸发结晶得到 NaHCO3 晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol CH4的质量是_____g,在标准状况下的体积为______L;含有约______个氢原子。
(2)将标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为______;配制300mL 0.5molL﹣1氯化钠溶液,需要1.5molL﹣1的氯化钠溶液的体积是______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com