
【题目】已知在1×105Pa,298K条件下,1 g氢气燃烧生成水蒸气放出121kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C.H2(g)+![]() O2(g)=H2O(g) △H=+242kJ/mol
O2(g)=H2O(g) △H=+242kJ/mol
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ/mol
【答案】A
【解析】
1 g氢气燃烧生成水蒸气放出121kJ热量,则1 mol氢气燃烧生成水蒸气放出242kJ热量。正反应方向放热,逆反应方向就吸热。
A. 水分解吸热,1mol水蒸气分解吸收242kJ热量,H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol,故A正确;
O2(g) △H=+242kJ/mol,故A正确;
B.2mol氢气生成气态水放热484kJ,2H2(g)+![]() O2(g)=2H2O(g) △H=-484kJ/mol,故B错误;
O2(g)=2H2O(g) △H=-484kJ/mol,故B错误;
C.放热反应,焓变为负值, H2(g)+![]() O2(g)= H2O(g) △H=-242kJ/mol,故C错误;
O2(g)= H2O(g) △H=-242kJ/mol,故C错误;
D. 放热反应,焓变为负值, 2H2(g)+O2(g)=2H2O(g) △H= -484kJ/mol,故D错误。


科目:高中化学 来源: 题型:
【题目】纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产。
(1)起初,人们从盐碱地和盐湖中获得纯碱,但远远不能满足工业发展的需要,纯碱的化学式为________。
1791年,“路布兰制碱法”取得专利。该方法以硫酸、氯化钠、木炭、白垩石(主要成分为碳酸钙)为原料,但在20世纪20年代后被淘汰,因为生产过程中释放出HCl气体,该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备。
(2)1861年,“索尔维制碱法”问世,该方法是在用氯化钠溶液吸收两种工业废气时意外发现的,反应后生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱,氯化钠溶液吸收的两种气体为________(填字母)。
A.Cl2 B.NH3 C.SO2 D.CO2
(3)“侯氏制碱法”由我国化学工程专家侯德榜先生于1943年创立,是对“索尔维制碱法”的改进,将氨碱法制取碳酸钠与合成氨联合起来,大大提高了食盐的利用率,缩短了生产流程,减少了对环境的污染,至今仍为全世界广泛采用。
用如图所示装置可以模拟“加热碳酸氢钠制得纯碱”的过程。
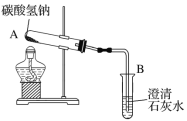
当观察到B中出现浑浊时,停止加热,A中发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用CH3OH![]() CO+2H2的方法来制取高纯度的CO和H2。我国科研人员通过计算机模拟,研究了在钯基催化剂表面甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用标注。下列说法正确的是( )
CO+2H2的方法来制取高纯度的CO和H2。我国科研人员通过计算机模拟,研究了在钯基催化剂表面甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用标注。下列说法正确的是( )

已知:甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式Ⅱ:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1
A.CH3OH*→CO*+2H2(g)的ΔH>0
B.①②都为O-H键的断裂过程
C.由活化能E值推测,甲醇裂解过程主要历经的方式应为Ⅱ
D.放热最多阶段的化学方程式为CHO*+3H*→CO*+4H*
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。

(1) D装置的作用是________,E中收集的气体是___________ (填名称)。
(2) 浓硫酸的作用是 _____________。
(3) A中发生反应的化学方程式为____________。
(4) C中发生反应的化学方程式为_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应④2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为
A.488.3 kJ/molB.-224.15 kJ/mol
C.-488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是
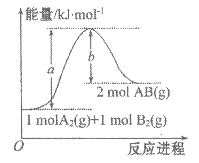
A.每生成2分子AB吸收b kJ热量
B.该反应的反应热ΔH= +(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A-A键和1mol B-B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液(主要成分为![]() )广泛应用于杀菌消毒。某化学学习小组用甲烷燃料电池电解饱和食盐水制备“84”消毒液,装置如图所示,
)广泛应用于杀菌消毒。某化学学习小组用甲烷燃料电池电解饱和食盐水制备“84”消毒液,装置如图所示,![]() ,
,![]() ,
,![]() ,
,![]() 均为惰性电极,下列说法正确的是( )
均为惰性电极,下列说法正确的是( )
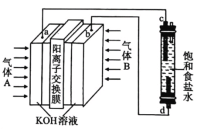
A.气体B为甲烷
B.电解装置中的总反应为NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
C.消耗2.24L(标准状况)甲烷,K+通过交换膜向左室移动0.8mol
D.甲烷发生的电极反应方程式为CH4-8e-+8OH—=CO2↑+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com