
科目:高中化学 来源: 题型:选择题
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g)放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g)的△H<0 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素的金属性比第IIA族元素的金属性强 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA元素 | |
| C. | 碱金属的熔点和密度都是随着原子序数的增大而增大 | |
| D. | 如果发现了原子序数为117号元素,它应该属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | A-A | B=B | A-B |
| 键能kJ/mol | 236 | 406 | 163 |
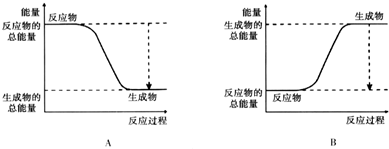
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
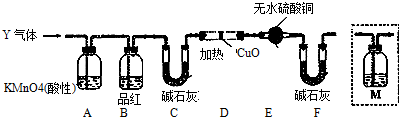
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
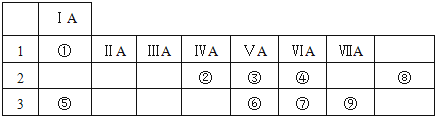
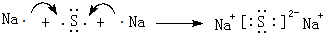 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合理使用化肥可以提高农作物的产量 | |
| B. | 生活中常使用热的纯碱溶液去除油污 | |
| C. | 明矾具有强氧化性,常用于自来水的杀菌消毒 | |
| D. | 船舶外壳装上锌块可以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
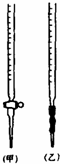 乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O
乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com