
分析 (1)向FeCl2和KSCN的混合溶液中加入氯水,氯气具有氧化性能氧化氯化亚铁为氯化铁,铁离子结合硫氰酸根离子形成血红色溶液;
(2)向AgNO3溶液中加入氯水,氯水中的氯离子结合银离子生成白色沉淀;
(3)氯气和水反应生成盐酸和次氯酸;
解答 解:(1)向FeCl2和KSCN的混合溶液中加入氯水,氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,铁离子结合硫氰酸根离子形成血红色溶液,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:溶液变红;2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3;
(2)向AgNO3溶液中加入氯水,氯水中的氯离子结合银离子生成白色沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓,
故答案为:产生白色沉淀;Ag++Cl-=AgCl↓;
(3)氯气和水反应生成盐酸和次氯酸,盐酸具有酸性,氯水具有漂白性,向氯水中滴加石蕊试液,溶液变红,起作用的微粒是H+,后又褪色,起作用的微粒是HClO,
故答案为:H+;HClO.
点评 本题考查了氯气及其化合物性质的分析判断,主要是氯水成分中各微粒的作用分析判断,注意次氯酸的漂白性,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
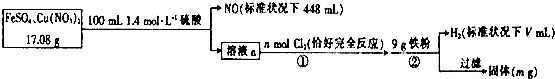
| A. | V=2240 | |
| B. | n=0.02 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量的两种白色固体分别加入1 mol/L的盐酸中,看有无气泡产生 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加BaCl2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| C. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放射元素 | B. | ⅦA族元素 | C. | 卤化银 | D. | ⅠA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1的AlCl3溶液 | B. | 20 mL 0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30 mL 0.2 mol•L-1的KCl溶液 | D. | 100 mL 0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com