
【题目】在室温下,向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生碘化亚铜(CuI)沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色。
(1)该反应中氧化剂是__________;
(2)该反应的氧化产物是__________;
(3)1mol氧化剂在反应中得到电子的物质的量为__________;
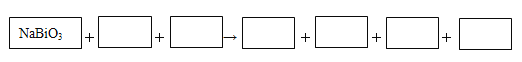
(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4 。请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并用单线桥表示电子转移的方向和数目。
【答案】
(1)Cu(IO3)2;(2)I2;(3)11mol
(4)10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O;![]()
【解析】
试题分析:(1)向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色,则反应过程中有碘生成,同时说明铜离子、碘酸根离子得电子发生还原反应,则Cu(IO3)2作氧化剂,碘化钾中碘离子失电子作还原剂,故答案为:Cu(IO3)2;
(2)该反应中Cu(IO3)2得电子生成CuI、I2,所以还原产物是CuI、I2,故答案为:CuI、I2;
(3)根据氧化剂和转移电子之间的关系式得转移电子的物质的量=1mol×[(2-1)+(5-0)×2]=11mol,故答案为:11mol;
(4)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4和H2O;该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,需得4个电子,所以其得失电子的最小公倍数为20,则其化学反应方程式为10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O,故答案为:10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O;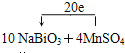 。
。


科目:高中化学 来源: 题型:
【题目】已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量D,现将16 g A与70 g B的混合物充分反应后,生成2 mol D和一定量C,则D的摩尔质量为_
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaHCO3和Na2CO3·xH2O的混合物7.4g, 加热到反应完全,并让产生的气体依次被无水氯化钙B和碱石灰C完全吸收,冷却至室温时,测得B管增重3.78g,C管增重044g,请计算下来问题:
(1)残留固体的成分是_______,质量是________。
(2)原混合物中NaHCO3的质量是_________。
(3)求出x的值(要求有计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
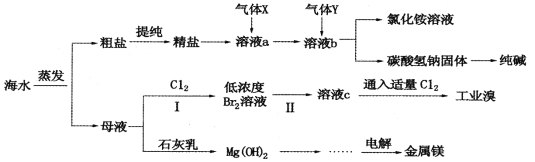
(1)利用海水可制备C12,为便于储存,可将C12液化,应采取的措施之一是__________。
(2)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解 ②加过量的BaCl2溶液 ③加过量的NaOH溶液 ④加过量的Na2CO3溶液 ⑤_________(填操作名称,下同) ⑥加适量的盐酸 ⑦___________。
(3)气体X为___________。溶液b中发生反应的化学方程式是______________________。
(4)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为_________________。步骤Ⅱ中通入空气吹出Br2,用SO2水溶液进行吸收,得到溶液c,反应的离子方程式为__________________。在实验室中,从工业溴中提取溴单质的实验操作名称是____________。
(5)工业上制取金属镁的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g)△H <0,下列说法正确的 ( )
2AB2(g)△H <0,下列说法正确的 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增 加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利 于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境生活、社会发展息息相关。下列叙述不正确的是( )
A. 燃煤中加入生石灰可降低含硫化合物的排放
B. 可用淀粉溶液检验食盐中是否加碘
C. 酿酒工业中使用的“酒曲”是一种酶
D. 可用蒸馏法、电渗析法淡化海水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH-
B.将过量SO2通入冷氨水中:SO2+NH3+H2O=HSO3-+NH4+
C.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com