
| A. | 铝的氧化物可用作于耐高温材料 | B. | Na2O2可用作漂白剂 | ||
| C. | 碱石灰可用于干燥CO2、O2等气体 | D. | 小苏打可用于治疗胃酸过多 |
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 不用铁片,改用铁粉 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用稀硫酸,改用浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| B. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L | |
| C. | 溶液中溶质质量分数为w,密度为ρ g•cm-3,溶质摩尔质量为M g•mol-1的溶液的物质的量浓度为$\frac{ρw}{M}$ mol/L | |
| D. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
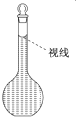 实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 | |
| B. | 用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 | |
| C. | 蒸馏水和0.1mol•L-1 NaOH溶液中的c(H+),前者大于后者 | |
| D. | 向含有少量Fe3+的MgCl2酸性溶液中加MgCO3,可将Fe3+转化成Fe(OH)3除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液 | |
| B. | c(H+)=1.0×10-7mol•L-1的溶液 | |
| C. | pH=7的溶液 | |
| D. | 室温下将pH=3的酸与pH=11的碱等体积混合后的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | C5H12有2种同分异构体 | |
| B. | C4H10O属于醇的结构有5种 | |
| C. | 甲、丙分别是CH4、苯的比例模型,乙能发生加成反应,丁在一定条件下能转化为乙 | |
| D. | 甲、乙能发生氧化反应,丙、丁不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
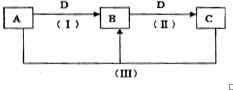 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).根据题意回答下列问题:
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).根据题意回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
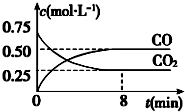 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com