
| A、常温常压下,1 mol羟基(-OH)所含的电子数为10 NA |
| B、由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2 g H2,则电路中通过0.2 mol电子 |
| C、在标准状况下,11.2 L NO与11.2 L 02混合后气体分子数为0.75 NA |
| D、l mol Na202,与足量水反应,转移电子的物质的量为2 mol |


科目:高中化学 来源: 题型:
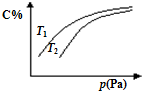 在密闭容器中,对于可逆反应A+3B?2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
在密闭容器中,对于可逆反应A+3B?2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )| A、若正反应方向△H<0,则T1>T2 |
| B、压强增大时,混合气体的密度减小 |
| C、A一定为气体 |
| D、B一定为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
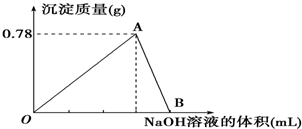 向20mL某物质的量浓度的AlCl3溶液中滴加2mol?L-1的NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴加2mol?L-1的NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
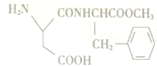 )可用于配制适用于糖尿病、高血压、肥胖症、心血管症的低糖、低热量的保健食品,下面是阿斯巴甜的一种合成路线
)可用于配制适用于糖尿病、高血压、肥胖症、心血管症的低糖、低热量的保健食品,下面是阿斯巴甜的一种合成路线
查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求书写下列热化学方程式
按要求书写下列热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol-NH2(氨基)中含有的电子数目为1.0NA |
| B、常温下,1L 0.1mol?L-1 CH3COONa溶液中含有的CH3COO-和Na+总数为0.2NA |
| C、标准状况下,2.24 LH2O中含有的原子总数为3NA |
| D、常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5mol/L |
| B、6mol/L |
| C、6.25mol/L |
| D、6.75mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com