
| 放电 |
| 充电 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 如图是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是( )
如图是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是( )| A、此图是1.0mol/L碳酸钠溶液滴定1.0mol/L HCl溶液的滴定曲线 |
| B、在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C、人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在 |
| D、若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| B、向FeBr2溶液中滴加足量的氯水:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
| C、向40mL、8mol/L的硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| D、Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
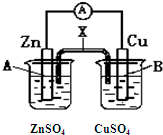 某电化学装置如图所示,下列说法正确的是( )
某电化学装置如图所示,下列说法正确的是( )| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是盐桥,取出X电流表指针仍然偏转 |
| C、若X是锌条,则A电极的质量会减少 |
| D、若X是铜条,则A电极的电极反应式是:Zn2++2e-=Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的裂解为深度裂化,产物主要为乙烯等小分子烃 |
| B、油脂“硬化”后性质变的更稳定 |
| C、蔗糖、淀粉、纤维素均会水解,反应后的产物相同 |
| D、2CH3CH2OH+O2→2CH3CHO+2H2O属于氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com