
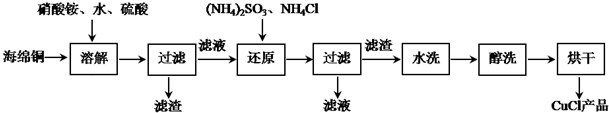
分析 海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜、加入氯化铵氯化发生反应2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸,结合相关物质的性质以及题目要求解答该题.
解答 解:海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜、加入氯化铵氯化发生反应2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸,
(1)铜和硝酸根离子反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
(2)还原步骤发生反应的离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+;
(3)70℃真空干燥、密封包装的原因是加快乙醇和水的挥发,防止CuCl在潮湿空气中水解氧化,故答案为:加快乙醇和水的挥发,防止CuCl在潮湿空气中水解氧化;
(4)由以上分析可知第二次过滤的滤液主要是硫酸铵和硫酸,故答案为:(NH4)2SO4 (或者(NH4)2SO4、H2SO4);
(5)根据题意知,氯化亚铜的溶度积大于氢氧化亚铜的溶度积,溶度积大的物质向溶度积小的物质转化,所以把CuCl固体和NaOH溶液混合,氯化亚铜和氢氧化钠反应生成氢氧化亚铜,加热时,氢氧化亚铜分解生成氧化亚铜沉淀.
故答案为:Cu2O;
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,铜离子在阴极发生还原反应生成CuCl,反应的电极方程式为Cu2++e-+Cl-=CuCl↓,故答案为:Cu2++e-+Cl-=CuCl↓.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、物质的性质、离子反应的书写等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
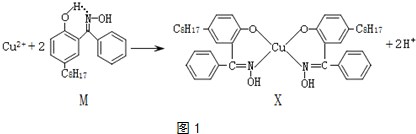
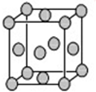 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题. .填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).
.填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).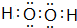 ,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.
,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaCl | NaHCO3 | NH4Cl | |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | α1<α2<α3<α4 | B. | α3<α2<α1<α4 | C. | α2=α3<α4<α1 | D. | α2=α3<α1<α4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com