
| A. | 一定相同 | B. | 一定不同 | C. | 可能不同 | D. | 无法确定 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)=0.40 mol•L-1•s-1 | B. | v(NH3)=1.20 mol•L-1•min-1 | ||
| C. | v(NH3)=0.60 mol•L-1•s-1 | D. | v(H2)=0.80 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 298 | 块状 | 2.00 |
| ② | |||
| ③ | 308 | 块状 | 2.00 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
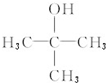 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.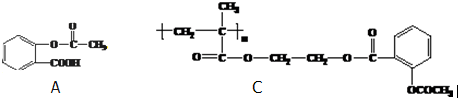
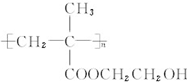 .
. 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KW是常温时的10-2倍 | B. | 温度不变冲稀10倍,pH=7 | ||
| C. | pH=6显弱酸性 | D. | c(H+)=10-6mol/L,溶液为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量红色粉末于试管中,并加入过量3mol•L-1 稀H2SO4,充分反应后,将上层清液分成两份 | (1)若有红色固体剩余,则假设2,3可能成立; (2)若无红色固体剩余,则假设1,3可能成立 |
| 若步骤1中有红色固体剩余; 步骤2:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液仍为蓝色,则假设2成立; |
| 若步骤1中有红色固体剩余; 步骤3:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液变为血红色,则假设3成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用向上排空气法收集氨气 | |
| B. | 氨气极易溶于水,因此加热浓氨水不会产生氨气 | |
| C. | 将两根分别蘸有浓氨水和浓硫酸的玻璃棒靠近时,有白烟产生 | |
| D. | 在实验室中,可用加热氢氧化钙和氯化铵的固体混合物的方法制取氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com