
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准 状况下的体积) |
| c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次 称量读数为2.33g |
| 阴离子符号 | 物质的量浓度(mol•L-1) |
分析 该混合物溶于水后得无色澄清溶液,一定不含Cu2+,a.加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-中至少一周,b.1.12L为氨气,氨气的物质的量为0.05mol,溶液中一定含有NH4+,并且物质的量为0.05mol;c.2.33g为硫酸钡,碳酸钡的物质的量为0.01mol;6.27g为硫酸钡和碳酸钡,碳酸钡的质量为:6.27g-2.33g=3.94g,物质的量为0.02mol;溶液中一定存SO42-、CO32-,根据离子共存可知,一定不存在Mg2+、Ba2+;再根据电荷守恒,判断是否存在钾离子,据此进行解答.
解答 解:该混合物溶于水后得无色澄清溶液,一定不含Cu2+,a.加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
b.1.12L为氨气,氨气的物质的量为0.05mol,溶液中一定含有NH4+,并且物质的量为0.05mol;
c.2.33g为硫酸钡,碳酸钡的物质的量为0.01mol;6.27g为硫酸钡和碳酸钡,碳酸钡的质量为:6.27g-2.33g=3.94g,物质的量为0.02mol;溶液中一定存SO42-、CO32-,根据离子共存可知,一定不存在Mg2+、Ba2+;
(1)该混合物中一定不存在的离子是Mg2+、Cu2+、Ba2+,故答案为:Mg2+、Cu2+、Ba2+;
(2)实验b发生反应的离子方程式为:NH4++OH-═NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(3)不溶于盐酸的2.33g沉淀为硫酸钡,物质的量是0.01mol,浓度为:c(CO32-)=$\frac{0.01mol}{0.1L}$=0.1mol/L;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,物质的量为0.02mol,硫酸根离子浓度为:c(SO42-)=$\frac{0.02mol}{0.1L}$=0.2mol/L;溶液中一定含有NH4+,并且物质的量为0.05mol,浓度是:$\frac{0.05mol}{0.1L}$=0.5mol/L;
故答案为:
| 阴离子符号 | 物质的量浓度(mol•L-1) |
| SO42- | 0.1 |
| CO32- | 0.2 |
点评 本题考查了常见离子的检验方法,题目难度较大,题量较大,试题涉及了常见离子的检验方法判断、离子方程式的书写,题中根据电荷守恒判断钾离子的存在为难点和易错点.


科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中,一定含非金属元素 | |
| B. | 共价化合物中,一定没有离子键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 离子化合物中一定含有金属元素和非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.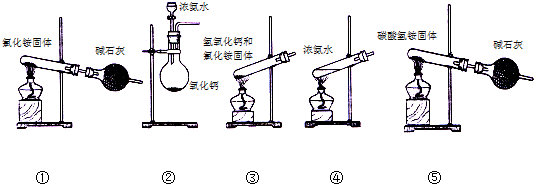
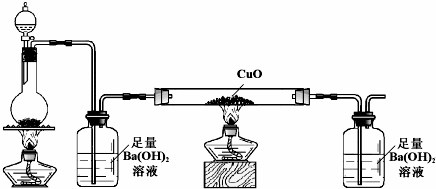
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2YZ3 | B. | XYZ2 | C. | X3YZ4 | D. | XYZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl、Na2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、K2SO4、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0kJ•mol-1,冰中氢键键能为20kJ•mol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a).若加水稀释,则CH3COOH?CH3COO-+H+向右移动,a增大,Ka不变 | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃.30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( )
食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( )| A. | 油酸的分子式为C18H34O2 | |
| B. | 油酸可与氢氧化钠溶液发生中和反应 | |
| C. | 1 mol油酸可与2 mol H2发生加成反应 | |
| D. | 1 mol甘油可与3 mol油酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
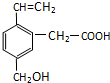 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )| A. | ①④ | B. | 只有⑥ | C. | 只有⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com