
【题目】Pb为第ⅣA元素。常见的化合价为+2和+4,其单质和化合物都有着广泛的用途。
己知Pb2+可以和EDTA|乙二胺四乙酸(HOOCCH2)2NCH2-CH2N(CH2COOH)2|形成无色的1:1的稳定络合物。
请回答下列问题:
(1)基态Pb原子价电子排布式为___
(2)碳、硅与铅同主族。碳纳米管可以制成透明导电的薄膜,其结构类似于石墨晶体,则多层碳纳米管的层与层之间靠___结合在一起。四卤化硅(SiX4)均是无机化工品,其沸点按F、Cl、Br、I依次升高的原因是____
(3)在EDTA中,碳原子的杂化方式有____、___。组成EDTA的四种元素中第一电离能最大的是____
(4)Pb(NO3)2中阴离子的立体构型是____,写出一个与该阴离子立体构型相同的分子的化学式___
(5)Sn与Pb同为第ⅣA元素。请用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角___120°(填“>” “<即或“=”)。
(6)Pb与Ti、O构成的晶体可用于制造复合电子陶瓷,该晶体的晶胞如图所示,其中Pb、Ti、O分别位于顶点、体心和面心,该晶体的化学式为___,若晶胞参数为a nm,则Pb与O间的最短距离为___nm,与Pb紧邻的O个数为___

【答案】6s26p2; 分子间作用力; 都是分子晶体,同时分子中没有氢键,所以它们的熔沸点通过比较范德华力来判断,随着相对分子质量的增大范德华力增大,所以沸点按F、Cl、Br、I依次升高; sp2; sp3; N; 平面三角形; SO3; 小于; PbTi3O; ![]() ; 8;
; 8;
【解析】
(1)基态Pb原子价电子排布式为6s26p2;
(2)其结构类似于石墨晶体,石墨晶体层与层之间靠范德华力连接,所以多层碳纳米管的层与层之间靠范德华力结合在一起;四卤化硅都是分子晶体,同时分子中没有氢键,所以它们的熔沸点通过比较范德华力来判断,随着相对分子质量的增大范德华力增大,所以沸点按F、Cl、Br、I依次升高;
(3)在EDTA中,碳原子的杂化方式有sp2 ,sp3;组成EDTA的四种元素中N的第一电离能最大;
(4)NO3-的立体构型是平面三角形;SO3也是平面三角形;
(5)根据价层电子对互斥理论推断SnBr2分子中含有一个孤电子对,所以键角小于120°;
(6)Pb、Ti、O分别位于顶点、体心和面心,Pb有8![]()
![]() =1个,Ti有6
=1个,Ti有6![]()
![]() =3个,O有一个,所以该晶体的化学式为PbTi3O,若晶胞参数为a nm,则Pb与O间的最短距离为体对角线的一半
=3个,O有一个,所以该晶体的化学式为PbTi3O,若晶胞参数为a nm,则Pb与O间的最短距离为体对角线的一半![]() nm,与Pb紧邻有8个氧原子;
nm,与Pb紧邻有8个氧原子;


科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是

A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池成本低、安全性好,有望在未来取代锂离子电池,某新型可充电钠离子电池放电的工作原理如图所示。下列分析错误的是( )
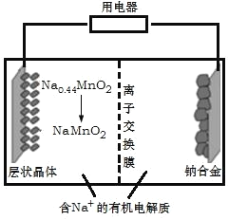
A. 出于环保考虑,应尽量避免使用重金属(如Pb)作为钠的合金化元素
B. 放电时,Na+由右室移向左室
C. 放电时,正极反应式为:Na0.44MnO2+0.56e-+0.56Na+=NaMnO2
D. 充电时,阴极质量变化4.6g时,外电路中通过0.1mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生反应的总化学方程式:2Fe+2H2O+O2=2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图所示。下列说法正确的是
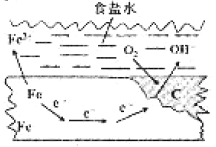
A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀生成的铁锈可以保护内层的铁不被腐蚀
C. 铁片腐蚀过程中负极发生的电极反应:2H2O+O2+4e-=4OH-
D. 铁片里的铁和碳与食盐水形成了无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为准确测定FeSO4的浓度,可用重铬酸钾标准溶液进行滴定。(已知重铬酸钾被还原为Cr3+)
步骤1.用分析天平准确称取2.9400g重铬酸钾,配制500mL重铬酸钾标准溶液;
步骤2.移取25.00mL所配制的重铬酸钾标准溶液于500mL锥形瓶中,用蒸馏水稀释至250mL,再加20mL浓硫酸,冷却后,加2~3滴试亚铁灵指示剂;
步骤3.用待测硫酸亚铁溶液滴定至溶液由橙黄到绿,由绿色刚变为红紫色为终点;
步骤4.记录消耗硫酸亚铁溶液的体积为18.70 mL。
(1)配制500mL重铬酸钾标准溶液需要的玻璃仪器有量筒、烧杯、 ____________________
(2)移取K2Cr2O7溶液选用的仪器是___________,盛装待测硫酸亚铁溶液选用的仪器是___________
A.50mL酸式滴定管 B.25mL碱式滴定管 C.25mL量筒
(3)氧元素位于周期表的______分区,铁元素在周期表中的位置是___________________,Fe2+的简化电子排布式为_________________,基态铬原子的价电子电子排布图为 __________________。
(4)测得FeSO4的浓度为 ______________ 。(小数点后保留两位数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) ![]() bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
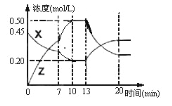
A. 根据上图可求得方程式中a∶b=1:3
B. 推测在第7min时曲线变化的原因可能是升温
C. 推测在第13min时曲线变化的原因可能是降温
D. 用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)由E形成的物质中硬度最大的是___(填名称),属于___(填“晶体类型”)。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是___,该碱溶液与D的最高价氧化物反应的离子方程式___。
(3)常用作光导纤维的是___。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序___。
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序___。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是___。
(7)元素I的氢化物的结构式为___;该氢化物常温下和元素K的单质反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com