
(1)氮气与氢气合成氨气、二氧化硫的催化氧化都是可逆反应,研究发现降低温度有利于平衡向生成氨气或三氧化硫的方向移动。但是在实际生产中,这两个反应都是在较高的温度下进行的,你能解释这是为什么吗?__________________________________________
(2)实验室中用碳酸钙与盐酸反应制备二氧化碳时,选择的试剂为块状碳酸钙固体而不是碳酸钙粉末,为什么?_______________________________________________________________
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:





 )用于医药中间体,也用于有机合成.请结合所学有机知识并利用提示信息设计合理方案并完成以对氯甲苯和甲醇为原料合成对甲氧基苯甲酸甲酯的合成(用合成路线流程图表示,并注明反应条件).
)用于医药中间体,也用于有机合成.请结合所学有机知识并利用提示信息设计合理方案并完成以对氯甲苯和甲醇为原料合成对甲氧基苯甲酸甲酯的合成(用合成路线流程图表示,并注明反应条件).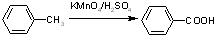 ,
, 高温下易脱去羧基.
高温下易脱去羧基.
| 浓H2SO4 |
| 170℃ |
| Br2 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
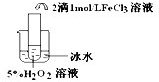
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |

查看答案和解析>>
科目:高中化学 来源:学习高手必修二化学人教版 人教版 题型:043
请利用所学知识完成下列问题:
(1)氮气与氢气合成氨气、二氧化硫的催化氧化都是可逆反应,研究发现降低温度有利于平衡向生成氨气或三氧化硫的方向移动.但是在实际生产中,这两个反应都是在较高的温度下进行的,你能解释这是为什么吗?
(2)实验室中用碳酸钙与盐酸反应制备二氧化碳时,选择的试剂为块状碳酸钙固体而不是碳酸钙粉末,为什么?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年云南省玉溪一中高一下学期期末考试化学试卷(带解析) 题型:实验题
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分。利用已学知识对下列实验进行分析并填空:
Ⅰ.
实验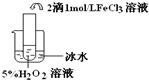
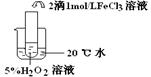
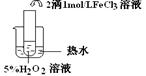
实验结论 结论:
FeCl3在实验中的作用为:
反应方程式
II.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示: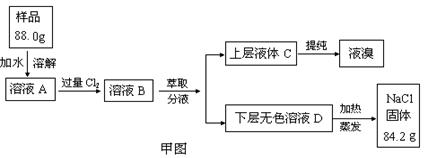
阅读上述资料和实验过程,完成下列填空:
(1)请从下方乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品。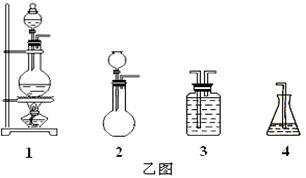
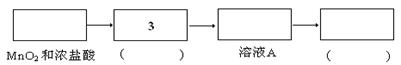
(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为 (填选项字母)
A. 碘水 B. 淀粉碘化钾溶液
C. 新制氯水和四氯化碳 D. 食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A. 四氯化碳 B. 水 C. 乙醇 D. 苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为 %
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com