
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 现象 | 结论 |
| 步骤一: 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 |
产生蓝色沉淀 | 猜想一不成立 猜想一不成立 |
| 步骤二: 往探究活动III溶液中加入乙醚,充分振荡 往探究活动III溶液中加入乙醚,充分振荡 |
乙醚层呈血红色 乙醚层呈血红色 |
“猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次数 | 滴定前(mL) | 滴定后(mL) |
| 1 | 0.40 | 21.10 |
| 2 | 0.10 |
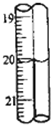 第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为
第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
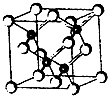 (2011?南京模拟)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.砷化镓的品胞结构如图.试回答:
(2011?南京模拟)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.砷化镓的品胞结构如图.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com