
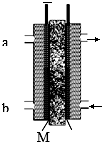
 甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:分析 ①正极上氧气得到电子和二氧化碳反应生成碳酸根;
②甲醇在负极失电子,b侧通入,电解质中阴离子向负极移动;
③根据甲醇和转移电子之间的关系式计算转移电子的物质的量,再计算质量.
解答 解:①正极上氧气得到电子和二氧化碳反应生成碳酸根,电极反应为O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
②根据图片知,甲醇在负极失电子,b侧通入,M、N是离子交换膜,只能阴离子通过,碳酸根离子在负极上发生反应,所以碳酸根离子从右向左移动,
故答案为:甲醇;从右到左;
③根据CH3OH-6e-+3CO32-=4CO2+2H2O知,当有3.2g甲醇发生反应时转移电子的物质的量0.6mol,CuSO4只有0.1mol,转移0.2mol电子时已经消耗完毕,析出Cu的质量为6.4g.
故答案为:6.4g.
点评 本题考查了化学电源新型电池,从电极反应式、离子移动方向、物质的量的计算等方面考查,正确理解原电池原理即可解答,难点是电极反应式的书写,书写时要结合电解质特点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 17g氨气中所含质子数为10NA | |
| B. | 2.4g金属镁变成镁离子时失去电子数为0.1NA | |
| C. | 在标准状况下,22.4L氧气中所含的氧原子数为NA | |
| D. | 在25℃、压强为1.01×105Pa时,28g氮气所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2 $\stackrel{电解}{→}$Mg | |
| C. | Na$→_{△}^{O_{2}}$Na2O2$\stackrel{H_{2}O}{→}$NaOH | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$\stackrel{蔗糖△}{→}$Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol OH-中含有9NA个电子 | |
| B. | 28 g CO气体中含有NA个氧原子 | |
| C. | 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol•L-1 KI溶液的锥形瓶中依次 滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为 蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 除去乙烷中少量的乙烯:催化条件下通入H2 | |
| B. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2Te>H2Se>H2S>H2O | B. | KCl>NaCl>LiCl>HCl | ||
| C. | Sr>Ba>Ca>Be | D. | 金刚石>SiC>晶体硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com