
| 实验 编号 | T/℃ | 大理石 规格 | HNO3浓度 (mol?L-1) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | ||||
| ③ | 粗颗粒 | 2.00 | ||
| ④ | 25 |
分析 由于①和②探究硝酸浓度对反应速率的影响,除了硝酸的浓度不同,其他条件必须相同,温度应该为25℃,大理石规格为粗颗粒,硝酸浓度为1.00mol/L;
由于①和③中大理石规格、硝酸浓度相同,则探究的应该是温度对反应速率的影响,则③的温度应该为35℃;
实验①和④的温度相同,探究的应该是大理石规格对反应速率影响,其他条件必须相同,硝酸浓度为2.00mol/L、大理石规格为细颗粒,据此进行解答.
解答 解:由于①和②探究硝酸浓度对反应速率的影响,除了硝酸的浓度不同,其他条件必须相同,温度应该为25℃,大理石规格为粗颗粒,硝酸浓度为1.00mol/L;
由于①和③中大理石规格、硝酸浓度相同,则探究的应该是温度对反应速率的影响,则③的温度应该为35℃;
实验①和④的温度相同,探究的应该是大理石规格对反应速率影响,其他条件必须相同,硝酸浓度为2.00mol/L、大理石规格为细颗粒;
(Ⅱ)实验②和③除了温度不同外,其他条件都相同,所以是探究的是温度对反应速率影响,
(Ⅲ)验①和④应该探究的是大理石规格对反应速率影响,
故答案为:
| 实验 编号 | T/℃ | 大理石 规格 | HNO3浓度 (mol?L-1) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | 25 | 粗颗粒 | 1.00 | |
| ③ | 35 | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
点评 本题主要考查了影响化学反应速率的因素的探究,题目难度中等,试题综合性比较强,要好好利用控制变量,希望同学们认真分析、综合把握;特别是实验步骤设计中的对比,要前后联系,抓住要改变的条件,问题就会迎刃而解.


科目:高中化学 来源: 题型:多选题
| A. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0kJ/mol (△H代表乙醇的燃烧热) | |
| B. | HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(1)△H=-57.3kJ/mol (△H代表中和热) | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6 kJ/mol (反应热) | |
| D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol (反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 用醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 实验室用溴和苯在催化剂作用下制溴苯: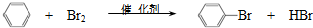 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
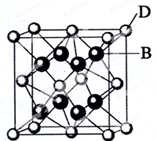 已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,D的原子序数比E小5,又知E是周期表中1-18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | H2SO4与Ba(OH)2反应:Ba2++SO42-═BaSO4 | |
| C. | 足量铁溶于稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| B. | 25℃时,pH=3的氯化铵溶液中:c(OH-)=1.0×10-11mol•L-1 | |
| C. | 25℃时,pH=4的氯化铵溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com