
(14分)砷(As)广泛分布于自然界,其原子结构示意图是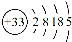 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
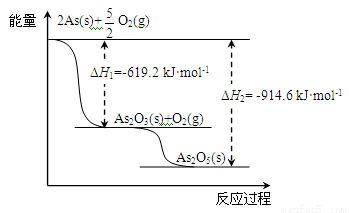
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。
(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+  AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
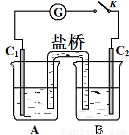
① A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3
的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针
向右偏转。此时C2上发生的电极反应是 。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH
溶液,可观察到电流计指针 (填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。As2O5与NaOH溶液反应的离子方程式是 。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g。
(1)ⅤA 弱 (2) As2O5(s) = As2O3(s) + O2(g) ?△H= +295.4 kJ·mol-1
(3)①AsO43-+ 2e- + 2H+ = AsO33-+ H2O ② 向左偏
(4)①As2O5 + 6OH- = 2 AsO43- + 3H2O ② 0.115
【解析】
试题分析:(1)最外层有5个电子,则As位于第ⅤA族,由同主族位置和元素周期律可知,非金属性N>As,则As的气态氢化物的稳定性比NH3弱,故答案为:ⅤA;弱;
(2)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ?mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ?mol-1;
(3)①B中滴加浓盐酸时发生AsO43-+2I-+2H+ AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO32-+H2O;
AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO32-+H2O;
②向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH- AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,可观察到电流计指针向左偏;
AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,可观察到电流计指针向左偏;
(4)①根据反应物和生成物可写出反应的离子方程式为As2O5 + 6OH- = 2 AsO43- + 3H2O;
②根据2Na2S2O3+I2=Na2S4O6+2NaI可知反应中消耗的碘的物质的量是0.03L×0.1mol/L×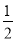 =0.0015mol,而加入的碘是0.025mol/L×0.02L=0.0005mol,所以由AsO42-氧化生成的碘是0.0015mol-0.0005mol=0.001mol,则根据方程式AsO43-+2I-+2H+
=0.0015mol,而加入的碘是0.025mol/L×0.02L=0.0005mol,所以由AsO42-氧化生成的碘是0.0015mol-0.0005mol=0.001mol,则根据方程式AsO43-+2I-+2H+ AsO33-+I2+H2O可知AsO42-的物质的量是0.001mol。所以由As2O5 + 6OH- =2 AsO43- + 3H2O可知As2O5的物质的量是0.001mol÷2=0.0005mol,其质量是0.0005mol×230g/mol=0.115g。
AsO33-+I2+H2O可知AsO42-的物质的量是0.001mol。所以由As2O5 + 6OH- =2 AsO43- + 3H2O可知As2O5的物质的量是0.001mol÷2=0.0005mol,其质量是0.0005mol×230g/mol=0.115g。
考点:考查元素的位置及元素周期律、热化学方程式、原电池的工作原理、混合物含量测定等


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
下列叙述错误的是
(1)石油裂解、煤的气化、溶液导电都属于化学变化
(2)H2S水溶液是弱酸,HCl水溶液是强酸,可以验证硫元素的非金属性比氯元素弱
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物
A.全部 B.(2)(3)(4)
C.(1)(2)(3)(5) D.(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
下列说法正确的是
A.海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t。由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素”
B.活泼金属元素的氧化物一定是碱性氧化物,非金属元素的氧化物一定是酸性氧化物
C.氢氧化铁溶胶、甘油与乙醇的混合液、含PM2.5的大气均具有丁达尔效应
D.绿色化学期望利用化学原理从源头消除污染,在化学过程中充分利用原料,实现零排放
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
反应A(g)+B(g) C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变。
C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变。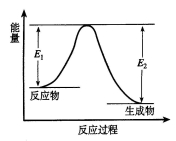
下列说法正确的是
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,17g羟基中含有的电子数目为10NA
B.常温常压下,28g由C2H4和C3H6组成的混合气体中含有的碳原子数目为2NA
C.0.05mol熔融的NaHSO4中含有的离子数目为0.15NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。下列说法不正确的是
A.生产水泥的原料是大理石、纯碱、石英,其组成一般为Na2O·CaO·6SiO2
B.Si与NaOH溶液反应的离子方程式为:Si+2OH-+H2O = SiO+2H2↑
C.焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是CO2
D.经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为25%
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
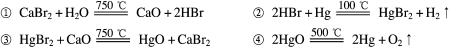
该方案的相关叙述正确的是
A.该实验的目的是制取HBr B.该过程的副产品是Hg
C.该过程得到的气体只有H2 D.该过程的本质是水的分解
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:填空题
(8分)标准状况下,容积为V mL的烧瓶充满NH3。
(1)集满空气时,该烧瓶为a g,则集满NH3时的质量是_____g。
(2)烧瓶中气体的原子总数是_____个。
(3)用烧瓶中的NH3做喷泉实验,水充满烧瓶,假设NH3没有损失,该溶液中溶质的质量分数为_____,物质的量浓度为_____mol·L-1[溶液的密度为ρ g·mL-1]。
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
二氧化钛是钛的重要化合物,钛白粉(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料.从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:
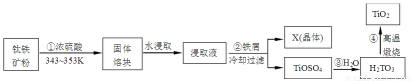
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为: .
(2)取少量浸取液,滴加KSCN溶液后呈血红色,说明溶液中存在 离子(填写离子符号),检验溶液中还存在Fe2+的方法是 (写明步骤、试剂和现象).
(3)浸取液与铁屑反应的离子方程式为 ;X(晶体)的化学式为 .
(4)第③步反应化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com