
【题目】下列指定反应的离子方程式正确的是
A. 稀硫酸与氢氧化钡溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B. 小苏打与稀盐酸反应:CO32-+2H+=CO2↑+H2O
C. 工业上电解熔融状态的氯化镁:MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
D. 向碳酸氢铵溶液中加入足量澄清石灰水:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3·H2O+H2O
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是 ( )

A.a曲线表示的离子方程式为:AlO2-+H++H2O ==Al(OH)3↓
B.b和c曲线表示的离子反应是相同的
C.M点时,溶液中沉淀的质量为3.9 g
D.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中完全正确的一组是( )
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池中,若Cu极生成0. 2 g H2,则电路通过电子0.2NA
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④常温常压下,16 g O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2NA
⑦标准状况下22. 4 L水中含分子数为NA
A. ①②③④⑤ B. ②④⑤⑥⑦ C. ②④⑤ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是( )
X | Y | Z | |
A | CO2 | SO2 | 饱和Na2CO3溶液 |
B | HCl | Cl2 | 饱和NaCl溶液 |
C | Fe2O3 | Al2O3 | NaOH溶液 |
D | Na2SO4溶液 | Na2CO3 | 盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A在铜催化下被氧化的生成物不能发生银镜反应。有关A的转化关系如下:
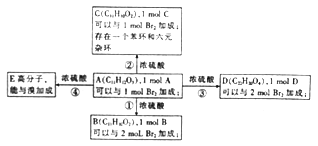
(1)属于酯类的化合物是___________(填代号)。
(2)①的反应类型是___________ ,理由是___________________________。
(3)已知A中的苯环只有一个取代基,A的结构式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在酸性条件下发生水解反应时,生成两种不同有机物,且这两种有机物的相对分子质量相等。则水解前的这种有机物是( )
A.甲酸甲酯B.乙酸异丙酯C.麦芽糖D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
(1)在恒温恒压条件下进行,反应正向进行的是________;反应逆向进行的是________;处于平衡状态的是________;无法判断是否达到平衡的是________。
A.单位时间内生成1mol N2,同时生成3mol NH3
B.单位时间内生成3mol N2,同时生成6mol N—H键
C.混合气体的密度不再随时间而改变
D.容器中气体的压强不再随时间而改变
(2)在一定温度下某恒容密闭容器中,充入3molH2和1mol的N2,2min达到平衡状态时,总的气体的物质的量变为原来的9/10,则此时N2的转化率为__________;
若此时放出的热量为18.44 kJ,则其热化学方程式为______________________________ .
根据所求出的热化学方程式,且已知1mol氮氮三键断裂需要为945.8kJ的能量,1mol氢氢键断裂需要436 kJ的能量,求1molN-H键断裂吸收的能量_____。
(3)氨气可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,
则氨燃料电池的负极电极反应为________________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com