
| A. | 44.80L | B. | 58.24L | C. | 80.64L | D. | 116.48L |
分析 根据反应:Mg17Al12+17H2═12Al+17MgH2,0.1molAl、MgH2的混合物与足量的稀盐酸反应放出H2与O2,1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,所以.1molG和足量的稀盐酸反应放出的H2是5.2mol,氢气燃烧消耗氧气是2.6mol,据此计算回答.
解答 解:根据反应:Mg17Al12+17H2═12Al+17MgH2,0.1molAl、MgH2的混合物与足量的稀盐酸反应放出H2,1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,所以.1molG和足量的稀盐酸反应放出的H2是5.2mol,H2与O2在KOH溶液中构成燃料电池,5.2mol氢气燃烧消耗氧气是2.6mol,体积是22.4L/mol×2.6mol=58.24L,故选B.
点评 本题考查学生物质的性质的有关计算以及原电池的工作原理知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑤⑦⑨ | D. | ③⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
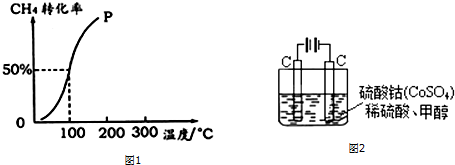
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向滴加有KSCN的FeCl2溶液,不断滴加氯水 | 溶液颜色先变红后褪色 | Fe2+先是被氧化为Fe3+,后来又被还原为Fe2+ |
| B | 向浓盐酸中加入少量碳酸钠溶液,将产生的气体通入苯酚钠溶液 | 苯酚钠溶液中出现白色浑浊 | 实验有缺陷,不能证明酸性:盐酸>碳酸>苯酚 |
| C | 在酸性KMnO4溶液中通入SO2 | 溶液褪色 | SO2具有漂白性 |
| D | 用标准浓度的烧碱溶液滴定未知浓度的盐酸,酚酞做指示剂 | 锥形瓶内溶液颜色由无色变为浅红色立即停止滴定 | 酸碱恰好中和 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫铁矿燃烧前需要粉碎,因为大块的不能在空气燃烧 | |
| B. | 沸腾炉出来的炉气需净化,因为其中的SO2会与杂质反应 | |
| C. | SO2氧化为SO3时,使用催化剂可以提高硫酸的产率 | |
| D. | SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期主族元素从左到右,氧化物对应的水化物酸性依次增强 | |
| B. | H2O比H2S的稳定性强,是因为其分子之间存在氢键 | |
| C. | 金刚石呈正四面体网状结构、C60呈笼状结构,这两种晶体中微粒间的作用力不完全相同 | |
| D. | NH4Cl属于离子化合物,该物质中只存在离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com