
分析 一元羧酸与碳酸氢钠反应的方程式为CnH2nO2+NaHCO3→CnH2n-1O2Na+CO2↑+H2O,结合反应的方程式计算该题.
解答 解:设A的分子式为CnH2nO2,则有:
CnH2nO2+NaHCO3→CnH2n-1O2Na+CO2↑+H2O
(14n+32)g 22.4L
8.8g 2.24L
则$\frac{(14n+32)g}{8.8g}$=$\frac{22.4L}{2.24L}$,解得n=4,即A的分子式为C4H8O2,
故答案为:C4H8O2.
点评 本题考查有机物分子式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握反应的关系式,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 2.5 mol•L-1 | C. | 5 mol•L-1 | D. | 2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) | |
| B. | c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L | |
| C. | c(C2O42-)<c(HC2O4-)<c(H2C2O4) | |
| D. | c(C2O42-)+c(HC2O4-)+c(H2C2O4)<c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
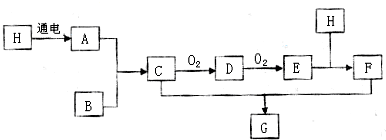
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:2 | B. | 10:1 | C. | 11:1 | D. | 12:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
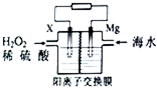 交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )| A. | X可为铁、铜、石墨等电极,发生氧化反应 | |
| B. | 每转移2 mol电子,2molH+由交换膜左侧向右侧迁移 | |
| C. | 该电池能将化学能全部转化成电能 | |
| D. | 正极的电极反应式为比O2+2e-+2H+═2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com