
【题目】完成下列填空:
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________.

(2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1___________,E2 _________ (填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH1= a kJ·mol-1N2(g)+O2(g)=2NO(g);ΔH2=b kJ/mol若1mol NH3还原NO至N2,写出该反应的热化学方程式__________(ΔH用a、b表示).
【答案】N2(g) + 3 H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1 390 减小 减小 NH3(g) +
2NH3(g) ΔH=-92kJ·mol-1 390 减小 减小 NH3(g) + ![]() NO(g) =
NO(g) = ![]() N2(g) +
N2(g) +![]() H2O(g),ΔH =
H2O(g),ΔH = ![]()
【解析】
⑴根据图像得出生成1mol气态氨气放出的热量,再写出热化学方程式。
⑵根据焓变等于断键吸收的热量减去成键放出的热量进行计算。
⑶使用催化剂会降低反应所需活化能。
⑷根据盖斯定律进行计算。
⑴根据图像可知生成1mol NH3(g)放出了46kJ的热量,因此N2(g)和H2(g)反应生成NH3(g)的热化学方程式为:N2(g) + 3 H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1,故答案为:N2(g) + 3 H2(g)
2NH3(g) ΔH=-92kJ·mol-1,故答案为:N2(g) + 3 H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1。
2NH3(g) ΔH=-92kJ·mol-1。
⑵设N—H的键能为x kJ·mol-1.,ΔH = 943 + 435×3-6x =-92,x = 390,故答案为390。
⑶使用铁触媒催化剂,活化能降低,因此E1减小,E2减小;故答案为:减小;减小。
⑷4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1= a kJ·mol-1 N2(g)+O2(g)=2NO(g) ΔH2=b kJ/mol将第1个方程减去第2个方程的3倍得到, NH3(g) + ![]() NO(g) =
NO(g) = ![]() N2(g) +
N2(g) +![]() H2O(g),ΔH =
H2O(g),ΔH = ![]() ,故答案为:NH3(g) +
,故答案为:NH3(g) + ![]() NO(g) =
NO(g) = ![]() N2(g) +
N2(g) +![]() H2O(g),ΔH =
H2O(g),ΔH = ![]() 。
。


科目:高中化学 来源: 题型:
【题目】I、下图为汽车尾气处理系统中“三元催化”的工作原理,NO和CO在催化剂作用下生成无污染性物质的方程式2NO+2CO![]() N2+2CO2。
N2+2CO2。
某课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
实验编号 | 实验目的 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 同种催化剂的比表面积/m2·g-1 | c(CO)不变时所用的时间/min |
① | 参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
② | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
③ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(1)实验编号②的实验目的为_______。
(2)课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是________。
II、某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
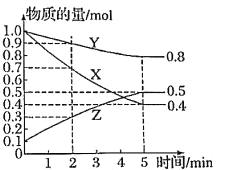
(1)该反应的化学方程式是______。
(2)该反应达到平衡状态的标志是
A. Y的体积分数在混合气体中保持不变
B. X、Y的反应速率比为3:1
C. 容器内气体压强保持不变
D. 容器内气体的总质量保持不变
E. 生成1 mol Y的同时消耗2 mol Z
(3)2~5min内用X表示的化学反应速率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
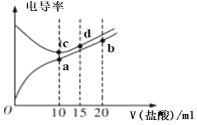
A.滴定氨水的过程应该选择甲基橙作为指示剂
B.a 点溶液中:c(H+)+c(NH4+)-c(OH-)=0.05 mol·L-1
C.b 点溶液中:c(H+)=c(OH-)+c(NH4+)+2c(NH3H2O)
D.a、b、c 三点的溶液中,水的电离程度c> b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应2A(g)+2B(g)![]() 2C(g)+3D(g)(正反应ΔH>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图。下列条件的改变与图中情况相符的是( )
2C(g)+3D(g)(正反应ΔH>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图。下列条件的改变与图中情况相符的是( )
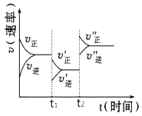
A.t1时,减小了A或B的物质的量浓度
B.t2时,升高了温度
C.t2时,增大了压强
D.t1时,加了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。
I.请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为________。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为_________(填化学式);
(3)元素①、③形成的18电子化合物的电子式为______;
(4)元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式);
(5)元素⑤、⑧的最高价氧化物对应的水化物的水溶液反应的离子方程式为_________。
II.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(6)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是__(填物质化学式)。若电解液体积为2L(
(7)甲醛(HCHO)燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为________;
②该电池工作时,电子的流向为___________(填“从左到右”或“从右到左”);
③右侧电极的电极反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应不正确的是( )
A.将少量铜屑放入浓硝酸中:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.用醋酸除去水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
C.将乙烷与溴蒸气混合置于光亮处生成一溴代物:CH3CH3+Br2![]() CH3CH2Br+HBr
CH3CH2Br+HBr
D.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技创新的产品设备在工作时,能量转化过程与氧化还原反应有关的是( )
|
|
|
|
①长征三号运载火箭用偏二甲肼为燃料 | ②嫦娥四号月球探测器上的太阳能电池板 | ③和谐号动车以350 km/h飞驰 | ④世界首部可折叠柔屏手机通话 |
A.①②B.③④C.②③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式如图所示:

⑴维生素C分子中—OH原子团的名称是__________________;维生素C__________________溶于水(填“易”或“难”),属于________________ 维生素(填“脂溶性”或“水溶性”)。
⑵维生素C又被称为抗坏血酸,它能促进胶原蛋白形成,所以能防治_____________
⑶一个人每天摄入约100mg维生素C就能满足需要,下列物质中含有丰富维生素C的是____
A.苦瓜 B.鸡蛋 C.豆腐 D.沙丁鱼
⑷“服用维生素C,可使食物中的三价铁离子还原成二价铁离子”这句话说明:维生素C具有_____________性(填“氧化性”或“还原性”);维生素C在这一反应中发生了_____________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念,判断下列叙述正确的是![]()
A.![]() 溶于水后能导电,故C
溶于水后能导电,故C![]() 为电解质
为电解质
B.![]() 、
、![]() 、
、![]() 、
、![]() 互为同素异形体
互为同素异形体
C.NaCl溶液和![]() 溶液均显中性,故两溶液中水的电离程度相同
溶液均显中性,故两溶液中水的电离程度相同
D.溶液与胶体本质区别为分散质微粒直径的大小不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com