
1)有下列几种物质
A.金刚石和石墨 B.C2H6和C5H12 C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2 E.35Cl和37Cl
属于同分异构体的是 ;属于同素异形体的是 ;属于同系物的是 ;属于同位素的是 .
(2)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是
A.两种不同元素的原子
B.一定是两种不同的离子
C.同一元素的原子和离子
D.两种不同元素的原子和离子.
考点:
同分异构现象和同分异构体;分子、原子、离子;分子式;芳香烃、烃基和同系物.
分析:
(1)同分异构体是指分子式相同,但结构不同的化合物;同素异形体是指同种元素形成的不同种单质;同位素是质子数相同,中子数不同的原子;同系物是结构相似,在分子组成上相差一个或若干个CH2原子团的化合物;
(2)根据不同种元素最本质的区别是质子数不同,可推断:不同质子数,说明肯定不是同种元素的粒子;相同电子数即“核外电子数相同”,说明它们核外电子结构相同,而它们的质子数不同,说明肯定不是两种不同元素的原子的两种粒子;据此即可判定正确的选项.
解答:
解:(1)CH3CH2CH2CH3和CH3CH(CH3)2分子式相同,但结构不同互为同分异构体;金刚石和石墨是同种元素形成的不同种单质,互为同素异形体;C2H6和C5H12结构相似,在分子组成上相差3个CH2原子团,互为同系物;35Cl和37Cl质子数相同,中子数,互为同位素;故答案为:D;A;B;E;
(2)A、不同元素的原子,电子数肯定不同,故A错误;
B、不同元素的离子,如Na+和Mg2+,都是离子,而且质子数不同,电子数相同,但是不同元素的原子和离子,如Ne和Na+,也是成立的,故B错误;
C、同一元素,质子数就一定相同,故C错误;
D、一种元素的原子和另一种元素的离子,可以是不同质子数、相同电子数的两种粒子,如Ne和Na+,故D正确.
故选D.
点评:
本题涉及“五同概念”以及微粒的构成,解答(2)题必须理解不同质子数、相同电子数的含义,才能正确解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
可以把6种无色溶液:乙醇、苯酚、NaHCO3溶液、AgNO3溶液、KOH溶液、氢硫酸一一区分的试剂是( )
|
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 |
|
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将由
将由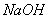 、
、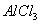 、
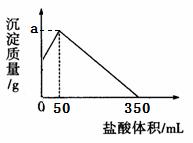
、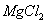 三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中逐滴加入3mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中逐滴加入3mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
根据题意回答下列问题:
(1)写出将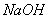 、
、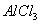 、
、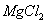 溶于水时发生反应的离子方程式:
溶于水时发生反应的离子方程式:
_____________________________________________________________
(2)a的值为__________
(3)求出原混合物各成分的物质的量(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
|
| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 |
|
| B. | O22﹣与S2﹣具有相同的质子数和电子数 |
|
| C. | 所有主族元素的简单离子所带电荷数与其族序数相等 |
|
| D. | 氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,LiH、LiD、LiT的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
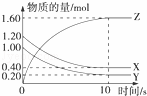
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①反应的化学方程式为 ;
②0~10s内,用Z表示的化学反应速率 ;
③X的转化率为 ;(转化率是指平衡时某物质反应的物质的量与起始物质的量的百分比)
(2)在一定温度下,可逆反应A(g)+3B(g)⇌2C(g)达到平衡的标志是
A.A的生成速率与C分解的速率相等
B.单位时间内生成nmolA,同时生3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2.
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸锂广泛应用于陶瓷和医药等领域。以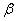 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O Al2O3
Al2O3 4SiO2)为原材料制备Li2CO3的工艺流程如下:
4SiO2)为原材料制备Li2CO3的工艺流程如下:
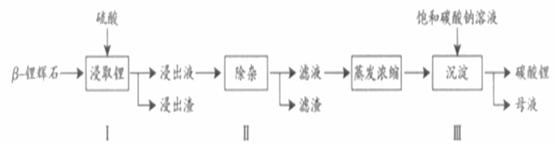
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,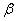 -锂辉石要粉碎成细颗粒的目的是_____________.
-锂辉石要粉碎成细颗粒的目的是_____________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________.
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________.
(5)从母液中可回收的主要物质是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。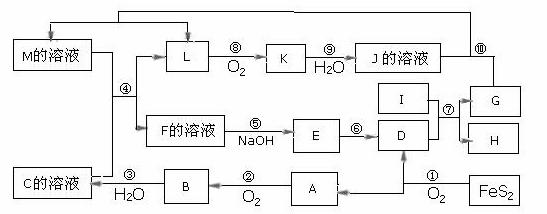
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com