
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P的化合物。由黑钨矿冶炼钨的工艺流程如下图:
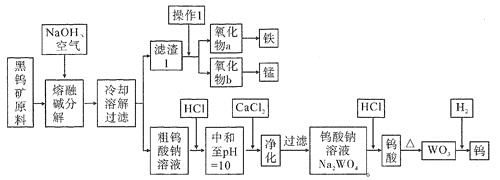
已知:
①滤渣1的主要成份是Fe3O4、MnO2。
②上述流程中,除最后一步外,其余步骤钨的化合价未变。
③常温下,钨酸难溶于水,钨酸钙(CaWO4)微溶于水。
回答下列问题:
⑴钨酸盐(FeWO4、MnWO4)中钨元素的化合价为________,为了加快黑钨矿在空气中熔融碱分解速率,可以采取_____________措施(写出其中一种即可)。
⑵请写出FeWO4在熔融条件下发生碱分解反应生成Fe3O4的化学方程式_________________________。
⑶操作1是工业上分离矿石的一种物理方法,此方法是_____________________________。上述流程中向粗钨酸钠溶液中加HCl调pH = 10后,溶液中的杂质阴离子为SiO32-、PO43-等,则“净化”过程中,加CaCl2的作用是____________________________________________。
⑷磷有两种同素异形体白磷和红磷,白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成Cu3P(Cu为+1价),反应方程式如下![]() 未配平
未配平![]() 。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为________。
。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为________。
CuSO4 + P4 + H2O = Cu3P + H2SO4+ H3PO4(未配平)
【答案】+6 粉碎原料![]() 适当增加空气量或搅拌等
适当增加空气量或搅拌等![]() 6FeWO4 + O2 + 12NaOH
6FeWO4 + O2 + 12NaOH ![]() 2Fe3O4+6 Na2WO4 + 6H2O 磁选(或其他合理答案) 生成CaSiO3、Ca3(PO4)2沉淀而除去 10mol
2Fe3O4+6 Na2WO4 + 6H2O 磁选(或其他合理答案) 生成CaSiO3、Ca3(PO4)2沉淀而除去 10mol
【解析】
⑴钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,根据化合物中正负化合价代数和为零得出;为了加快黑钨矿在空气中碱分解速率,可以采取粉碎原料、适当增加空气量、搅拌等措施;
⑵根据流程图的提示知,利用氧化还原反应写出黑钨矿在空气中熔融生成Fe3O4化学反应方程式;
⑶磁选是利用各种矿石或物料的磁性差异;溶液中的杂质阴离子为SiO32-、PO43-与CaCl2的反应生成CaSiO3、Ca3(PO4)2沉淀;
⑷根据氧化还原反应配平,根据氧化还原反应原理分析被氧化与物质的消耗关系。
⑴钨酸盐FeWO4为钨酸亚铁,钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,设钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+x,因化合物中正负化合价代数和为零,则+2+2+x+(-2)×4=0,解得x = +6;为了加快黑钨矿在空气中碱分解速率,可以采取粉碎原料、适当增加空气量、搅拌等措施;故答案为:+6;粉碎原料(适当增加空气量、搅拌等措施);
⑵根据流程图的提示知,黑钨矿在空气中熔融生成WO42-、Fe3O4、MnO2等,其中转化生成Fe3O4的化学反应方程式为6FeWO4 + O2 + 12NaOH ![]() 2Fe3O4+6 Na2WO4 + 6H2O;故答案为:6FeWO4 + O2 + 12NaOH
2Fe3O4+6 Na2WO4 + 6H2O;故答案为:6FeWO4 + O2 + 12NaOH ![]() 2Fe3O4+6 Na2WO4 + 6H2O;
2Fe3O4+6 Na2WO4 + 6H2O;
⑶磁选是利用各种矿石或物料的磁性差异,在磁力及其他力作用下进行选别的过程,Fe3O4是磁性氧化铁,可以通过磁选实现和MnO2的分离;上述流程中向粗钨酸钠溶液中加HCl调pH =10后,溶液中的杂质阴离子为SiO32-、PO43-等,则“净化”过程中,加CaCl2的作用是生成CaSiO3、Ca3(PO4)2沉淀而除去;故答案为:磁选(或其他合理答案);生成CaSiO3、Ca3(PO4)2沉淀而除去;
⑷根据氧化还原反应配平60CuSO4 +11P4 +60 H2O = 20Cu3P + 60H2SO4+24H3PO4,反应中有6mol白磷被氧化,消耗60mol硫酸铜,所以当被氧化的白磷的物质的量为1mol,消耗的硫酸铜的物质的量为10mol。


科目:高中化学 来源: 题型:
【题目】下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
A.CH3﹣CHCl﹣CH2﹣CH3
B.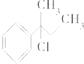
C.CH3﹣C(CH3)Cl﹣CH2﹣CH3
D.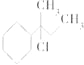
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜确定的联合制碱法又称侯氏制碱法,侯氏制碱法提高了食盐的转化率,缩短了生产流程,减少了对环境的污染,将制碱技术发展到了一个新的水平,贏得了国际化工界的高度评价。某学习小组按下列实验流程制备![]() 和
和![]() ,设计的部分装置如图所示。
,设计的部分装置如图所示。
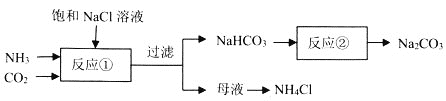
下列说法正确的是![]()
![]()
A. 可用装置及所给试剂制备
可用装置及所给试剂制备![]()
B.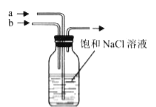 可先a先通入
可先a先通入![]() 至饱和,再由b通入
至饱和,再由b通入![]() 至饱和
至饱和
C.可由蒸发母液至出现大量晶体时,停止加热,利用余热蒸干得到纯净的![]()
D.可用![]() 溶液检验反应
溶液检验反应![]() 是否完全
是否完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理![]() 如图所示
如图所示![]() ,并测定电离平衡常数Kb.
,并测定电离平衡常数Kb.

(1)实验室可用浓氨水和X固体制取![]() ,X固体可以是_________;
,X固体可以是_________;
A.生石灰 ![]() 无水氯化钙
无水氯化钙 ![]() 五氧化二磷
五氧化二磷 ![]() 碱石灰
碱石灰
(2)检验三颈瓶集满![]() 的方法是________________________________________。
的方法是________________________________________。
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口,______________,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图所示。图中 ___点时喷泉最剧烈。

(4)从三颈瓶中用 ____________![]() 填仪器名称
填仪器名称![]() 量取20.00mL氨水至锥形瓶中,用0.05000mol/LHCl滴定。用pH计采集数据、电脑绘制滴定曲线并测定电离平衡常数Kb.
量取20.00mL氨水至锥形瓶中,用0.05000mol/LHCl滴定。用pH计采集数据、电脑绘制滴定曲线并测定电离平衡常数Kb.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+O2(g)=CO2 (g) △H1 ②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3 ④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是( )
A.△H1>0,△H3<0B.△H2>0,△H3>0
C.△H1=△H2+△H3D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
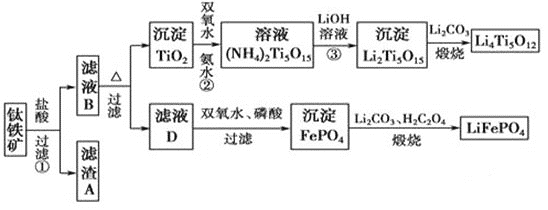
⑴钛铁矿在预处理时需要进行粉碎,其原因是__________________________________。
⑵过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________________________。

⑶过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是_______________________。
⑷写出由滤液D生成FePO4的离子方程式_____________________________________________
⑸由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的判断或表示方法正确的是
A.相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
B.从C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知相同条件下金刚石比石墨更稳定
C.由H+(aq)+OH-(aq)= H2O(l) △H=-57.3 kJ·mol-1,可知:含1 molCH3COOH的稀溶液与含1 molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)= 2 H2O(l) △H=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F是六种短周期主族元素,其中D、E同主族,C、E同周期,A的核电荷数等于其电子层数,B、D形成的化合物可用于制不粘锅的保护膜,B、E形成的某种化合物是一种常见的有机溶剂,C的次外层电子数是最外层电子数的4倍,D的单质可与水反应置换出F的单质。下列说法不正确的是
A.离子半径:![]()
B.含氧酸的酸性可能为:![]()
C.实验式为A2BF3的某种化合物可使澄清石灰水变浑浊
D.A与C形成的化合物溶于水显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示,下列说法不正确的是( )

A. 氨可用作制冷剂
B. 铵态氮肥一般不能与碱性化肥共同使用
C. 硝酸可用于制化肥、农药、炸药、染料、盐类等
D. 某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com