
【题目】常温下,在20.0mL0.10molL-1氨水中滴入0.10molL-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10molL-1氨水的电离度为1.32%,下列有关叙述不正确的是( )
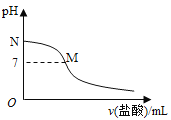
A. 该滴定过程应该选择甲基橙作为指示剂
B. M点对应的盐酸体积大于20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D. N点处的溶液中pH小于12
【答案】D
【解析】
A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,所以应选择甲基橙作指示剂;
B.如果M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,溶液应该呈酸性;
C.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制;
D.N点为氨水溶液,氨水浓度为0.10molL-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3mol/L,c(H+)=![]() mol/L=7.6×10-12mol/L。
mol/L=7.6×10-12mol/L。
A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,所以应选择甲基橙作指示剂,所以盐酸滴定氨水需要甲基橙作指示剂,故A不选;
B.如果M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,氯化铵中铵根离子水解导致该点溶液应该呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20.0mL,故B不选;
C.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制,水的电离程度很小,该点溶液中离子浓度大小顺序是c c(NH4+)=c(Cl-)>c(H+)=c(OH-),故C不选;
D.N点为氨水溶液,氨水浓度为0.10molL-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3mol/L,c(H+)=![]() mol/L=7.6×10-12mol/L,所以该点溶液pH<12,故选D;
mol/L=7.6×10-12mol/L,所以该点溶液pH<12,故选D;
综上所述,本题答案为D。


科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
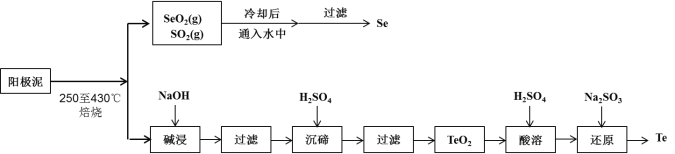
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
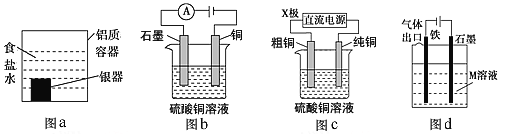
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组开展下列实验探究活动:

(1)装置A中反应的化学方程式为_____。
(2)设计实验:利用装置A中产生的气体证明+4价硫具有氧化性:_____。
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:

装置连接顺序为A、C、__、__、D、F,其中装置C的作用是_____,通过___________________现象即可证明亚硫酸的酸性强于次氯酸。
(4)利用G装置可测定装置A残液中SO2的含量。量取 1mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2=H2SO4),然后用0.1000mol/LNaOH标准溶液进行滴定,至终点时消耗NaOH溶20.00mL。

①G中球形冷凝管的冷凝水进口为_____(填“a”或“b”)。
②残液中SO2含量为____g/L。
③经多次测定发现,测定值始终高于实际值,则其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中
(1)互为同分异构体的是________,
(2)互为同素异形体的是________,
(3)互为同位素的是________,
(4)属于同一物质的是________。
①C(CH3)4和C4H10
②![]() 和
和![]()
③35Cl和37Cl
④![]() H2O和
H2O和![]() H2O
H2O
⑤石墨和金刚石
⑥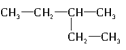 和
和![]()
⑦(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH3
⑧H2 D2 T2
⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。
(1)某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的表现
C.用铝片、铜片、硫酸铝溶液、硫酸铜溶液,比较二者的活动性
D.分别做铝片、铜片与NaOH溶液反应的实验
E.将铝片、铜片用导线连接后共同投入稀盐酸中接入电流计,观察电流方向
上述方案中能达到实验目的的是_________________。
(2)现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是________ (填字母代号),作负极的物质发生了________反应(填“氧化”或“还原”)。
(3)将纯锌片和纯铜片按如图所示方式插入100mL相同浓度的稀硫酸一段时间,回答下列问题:

①下列说法正确的是________ (填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的酸性均减弱
②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<”或“=”)。原因是________。
③当甲中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 mol NO2的能量变化)。1 mol NO氧化为NO2的焓变△H=___________。
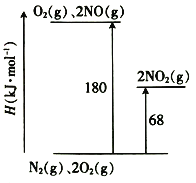
(2)某温度下,反应的平衡常数如下:
a.2NO2(g) ![]() N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) ![]() N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是__________(填“a”或“b”);反应2NO(g)+O2(g) ![]() 2NO2(g)的K=_____________。
2NO2(g)的K=_____________。
(3)已知反应2NO(g)+O2(g) ![]() 2NO2的正反应速率v正=k1Cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
2NO2的正反应速率v正=k1Cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
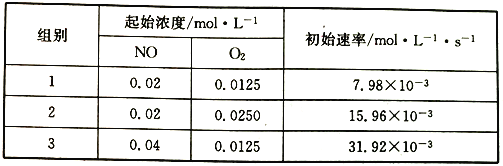
则k1=______________,m=______________,n=______________,
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2慢反应
2NO2慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是________(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如下变化。
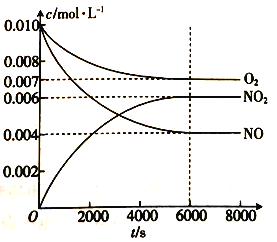
①NO的平衡转化率为 _______________。
②该温度下反应2NO(g)+O2(g)![]() 2NO2(g)的平衡常数为______________(保留整数)
2NO2(g)的平衡常数为______________(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中的CO、NO、NO2、SO2都能使人中毒,其中易与人体中的血红蛋白结合,使血红蛋白失去运载O2能力的是( )
A. CO B. NO C. NO2 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酸雨”的形成主要是由于( )
A. 森林遭乱砍滥伐,破坏了生态平衡 B. 工业上大量燃烧含硫燃料
C. 大气中二氧化碳的含量增多 D. 汽车排出大量尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com