
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:2 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
 ;故答案为:
;故答案为: ;
; ,
, ;
;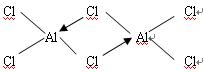 ;
; ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 溶解 |
| 沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

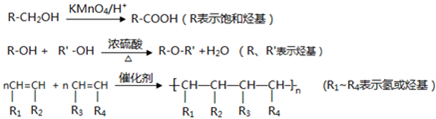
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
| D、反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂Z | 离子X | 离子Y |
| A.NH3.H2O B.AgNO3 C.Na2SO4 D.Ba(NO3)2 | Al3+ Cl- Ba2+ SO42- | Mg2+ CO32- Mg2+ Cl- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、②③⑤ |
| C、①③⑤ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com