
ij�¶��£���2mol A��2.8 mol B�������Ϊ2 L�ĺ����ܱ������У��������·�Ӧ��
aA��g��+B��g�� 2C��g��+ D��s�� ��5 min��ﵽƽ�⡣ƽ��ʱAΪ1.6mol���ų�������ΪQ����t0ʱ�̣�����ƽ����ϵ�з�����ķ�֮һ�Ļ�����壬��ƽ����ϵ��c(A)Ϊ0.6mol��L��
2C��g��+ D��s�� ��5 min��ﵽƽ�⡣ƽ��ʱAΪ1.6mol���ų�������ΪQ����t0ʱ�̣�����ƽ����ϵ�з�����ķ�֮һ�Ļ�����壬��ƽ����ϵ��c(A)Ϊ0.6mol��L��
��1�� 5 min����B��ʾ�÷�Ӧ�Ļ�ѧ��Ӧ����Ϊ ��
��2�����¶��£��˿��淴Ӧ���淴Ӧ��ƽ�ⳣ��Ϊ ��
��3��a��ֵΪ ��
��4������˵��һ����˵��������Ӧ�Ѵﵽƽ��״̬���� ��
�ٵ�λʱ����ÿ����1molB��ͬʱ������2mol��C ��D�����ʵ������ٱ仯
�ۻ��������ܶȲ��ٱ仯 �ܻ�������ƽ����Է����������ٱ仯
����ϵ��ѹǿ���ٱ仯
��5�����¶��£�ijͬѧ���������ʵ�飬���ڿո���������������Q�ı���ʽ��ʾ��
| ��ʼ n��A��/mol | ��ʼ n��B��/mol | ��ʼ n��C��/mol | ��ʼ n��D��/mol | �ﵽƽ��ʱ�ų��������գ������� |
| 0 | 1.6 | 8 | ���� | |
��1�� 0.04mol/(L��min) (2��) ��2�� 6(2��) ��3�� 1 (2��) ��4�� �ڢۢ� (2��) ��5��8Q(2��)
���������������������֪��5 min��ﵽƽ�⡣ƽ��ʱAΪ1.6mol��Ũ��Ϊ0.8 mol��L����ƽ����ϵ�з�����ķ�֮һ�Ļ�����壬�൱�ڼ�Сѹǿ��ʣ��A��Ũ��Ϊ0.6mol��L����ƽ����ϵ��c(A)��Ϊ0.6mol��L��˵���ı�ѹǿƽ�ⲻ�ƶ����÷�Ӧ������������ϵ����ȣ�a=1����������ʽ��������������֪��
A��g��+B��g�� 2C��g��+ D��s��
2C��g��+ D��s��
��ʼŨ�ȣ�mol��L�� 1 1.4 0 0
ת��Ũ�ȣ�mol��L�� 0.2 0.2 0.4
ƽ��Ũ�ȣ�mol��L�� 0.8 1.2 0.4
��1�����ݹ�ʽV=��c/��t�������ݼ��㣬5 min����B��ʾ�÷�Ӧ�Ļ�ѧ��Ӧ����Ϊ0.04mol/(L��min)����2����ƽ��Ũ�ȴ���÷�Ӧ��ƽ�ⳣ������ʽ���㣬K=1/6�����淴Ӧ��ƽ�ⳣ��Ϊ6����3������������֪��a=1����4����ѧƽ��״̬���оݣ�����v��=v���жϣ�˫��ͬʱ�����ϱ����������жϣ��������䣬�Ѵ�ƽ�⡣����������Ϊƽ���־���� ����B������C ����Ϊ�淴Ӧ��������Ϊƽ���־�� ��D�����ʵ������ٱ仯������ƽ���־���۸����ܶȵĶ���ʽ�����������ܶ�Ϊ�������䲻�ٱ仯���Ѵ�ƽ�⣻�ܸ���M=m/n�����������Ϊ��������������ƽ����Է�������Ϊ�������䲻�ٱ仯���Ѵ�ƽ�⣻�ݵ��µ��������£���������ʵ���Ϊ��������ϵ��ѹǿΪ������������ƽ���־����������ѡ�ڢۢܣ���5�����ݵ�Чƽ��֪ʶ������Ͷ��;����ﵽͬһƽ��״̬����������ʽ������ƽ��ʱ����AΪ3.2mol,���յ�����Ϊ8Q��
���㣺���黯ѧ��Ӧ���ʺͻ�ѧƽ�����ؼ��㡣


 �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��2NO2(g) N2O4(g)����H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ����ʾ����ش�
N2O4(g)����H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ����ʾ����ش�
��1��a��ʱ��v(��) v���棩�����������������=������X�ߡ�Y���д���N2O4���� ��
��2����Ӧ�ڵ�10 min�ﵽƽ�⣬��ǰ10 min����N��2��ʾ�Ļ�ѧ��Ӧ����v(N��2)= mol��L-1��min-1�����¶��£���Ӧ��ƽ�ⳣ��K= (���÷�����ʾ)��
��3���ڵ�25���ӣ����еIJ����� ��
��4��a��b��c��d�ĵ��Ӧ��ʱ�̣�NO2���ʵ���Ũ����С�����˳���� ���ٴ�ƽ��ʱ��d��NO2�����������b��ʱ �������С������ȡ�����
��5�������ڵ�35���Ӵ���������ȥ0.4mol N2O4���������ʵ�����ʹ��Ӧ�ڵ�40���Ӵﵽƽ�⣬����ͼ���л����ӵ�35�����Ժ��������ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ������ע����������Ӧ�����ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO(g)+2H2(g) 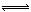 CH3OH(g)��
CH3OH(g)��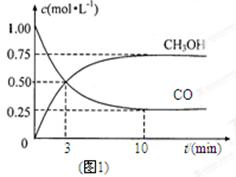
��1��ͼ1�DZ�ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯������ӷ�Ӧ��ʼ��ƽ�⣬��COŨ�ȱ仯��ʾƽ����Ӧ����v(CO)�� �� H2��ƽ��ת����Ϊ_________________________��
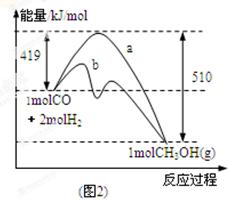
��2��ͼ2��ʾ�÷�Ӧ���й����������ı仯������a��ʾ��ʹ�ô���ʱ��Ӧ�������仯������b��ʾʹ�ô�����������仯��д����Ӧ���Ȼ�ѧ����ʽ ��
��3�����¶��£���Ӧƽ�ⳣ��K��______________������ֵ�����¶����ߣ�ƽ�ⳣ��K_________(����������䡱��С��)��
��4�����������£����д�ʩ����ʹ��Ӧ��ϵ��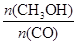 ����Ĵ�ʩ�� ��
����Ĵ�ʩ�� ��
a�������¶� b������He�� c���ٳ���2 molH2 d��ʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�̶�������CO2����Ч��������Դ�������ٿ����е��������塣��ҵ����һ����CO�������״�ȼ�ϵķ����� CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H �� ��49.0 kJ��mol��1��
CH3OH(g)��H2O(g) ��H �� ��49.0 kJ��mol��1��
ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���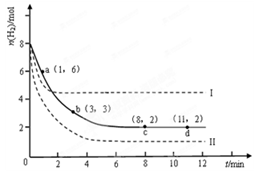
��1��a������Ӧ����_______������ڡ����ڻ�С�ڣ��淴Ӧ���ʡ�
��2������ʱ���ƽ����Ӧ����������__________��
| A��0��1min | B��1��3min | C��3��8min | D��8��11min |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��֪��SO2��g���� O2��g��
O2��g�� SO3��g�� ��H����98 kJ��mol��1��
SO3��g�� ��H����98 kJ��mol��1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��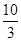 �����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� ������ĸ����
| A�������¶Ⱥ�����������䣬����1.0 mol O2 |
| B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3 |
| C�������¶� |
| D���ƶ�����ѹ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0.036 | 0.010 | 0.0038 |
 CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�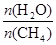 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��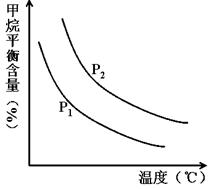
 CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ж������������N2O5��һ�������������������ʺ��Ʊ��յ����ǵĹ�ע��
��1��һ���¶��£��ں����ܱ�������N2O5�ɷ������з�Ӧ��2N2O5(g) 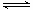 4NO2(g)��O2(g) ���SH��0
4NO2(g)��O2(g) ���SH��0
�ٷ�Ӧ�ﵽƽ�������ͨ��һ�����������N2O5��ת���ʽ�___�����������С���������䡱����
���±�Ϊ��Ӧ��T1�¶��µIJ���ʵ�����ݣ�
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol��L��1 | 5.00 | 3.52 | 2.48 |
 ��(������NO2�ۺϳ�N2O4)����N2O5��ת����a1�� �����¶��·�Ӧ��ƽ�ⳣ��K��_______��
��(������NO2�ۺϳ�N2O4)����N2O5��ת����a1�� �����¶��·�Ӧ��ƽ�ⳣ��K��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)��ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ_____________��Kֵ��С���¶ȵĹ�ϵ�ǣ��¶����ߣ�Kֵ______________(�һ��������һ����С������������Ҳ���ܼ�С��)��
��2����һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO(g)ʮH2O(g) 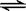 CO2(g)ʮH2 (g) ��H < 0 ��CO��H2OŨ�ȱ仯����ͼ���� 0��4min��ƽ����Ӧ����v(CO)��______ mol��(L��min)
CO2(g)ʮH2 (g) ��H < 0 ��CO��H2OŨ�ȱ仯����ͼ���� 0��4min��ƽ����Ӧ����v(CO)��______ mol��(L��min)
��3��t��(����850��)ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ϱ���
�ٱ���3min��4min֮�䷴Ӧ����_________״̬�� C1��ֵ_________0.08 mol��L (����ڡ�С�ڻ����)��
�ڷ�Ӧ��4min��5min�ʣ�ƽ�����淽���ƶ������ܵ�ԭ����________(��ѡ)�� ����5min��6min֮����ֵ�����仯�����ܵ�ԭ����__________(��ѡ)��
| A������ˮ���� | B�������¶� |
| C��ʹ�ô��� | D����������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�������£����淴ӦA2(g)+B2(g) 2C(g)��һ���ܱ������дﵽƽ��ʱ,���c(A2)=0��5mol��L-1��c(B2)=0��1mol��L-1��c(C)=1��6mol��L-1����
2C(g)��һ���ܱ������дﵽƽ��ʱ,���c(A2)=0��5mol��L-1��c(B2)=0��1mol��L-1��c(C)=1��6mol��L-1���� ��
�� ��C����ʼŨ�ȷֱ�Ϊa mol��L-1��b mol��L-1��g mol��L-1��ȷ����
��C����ʼŨ�ȷֱ�Ϊa mol��L-1��b mol��L-1��g mol��L-1��ȷ����
(l)a��gӦ����Ĺ�ϵʽΪ_____________��
(2)����Ӧ������Ӧ����ʼ���У���g=_________,a�����ֵΪ__________��
(3)����Ӧ���淴Ӧ����ʼ���У���b=_________��a����СֵΪ_________��
(4)b��ȡֵ��ΧΪ___________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com