
【题目】将两种不同物质的量浓度的Na2CO3溶液升高温度溶液中c(CO32-)变化如图所示,下列微粒的物质的量浓度关系正确的是( )
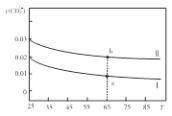
A.将溶液I升高温度,溶液pH减小
B.溶液a比溶液b中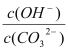 更大
更大
C.65℃时,向溶液a中加入1.06gNa2CO3固体,溶解后即为溶液b
D.溶液II一定存在:c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)
科目:高中化学 来源: 题型:
【题目】已知实验室制备1,2﹣二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.现在用溴的CCl4溶液和足量的乙醇制备1,2﹣二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | ﹣1l6 |
回答下列问题:
(1)制备1,2﹣二溴乙烷的合成路线
(2)在装置C中应加入 ,(填正确选项前的字母)其目的是
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)装置B的作用是 ;
(4)若产物中有少量副产物乙醚.可用 的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,以下不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有如下A、B两反应:
A: 2NaOH+H2SO4=Na2SO4+2H2O;B:Zn+H2SO4=ZnSO4+H2↑
则A、B反应能设计成为原电池的是____(填“A”或“B”)。
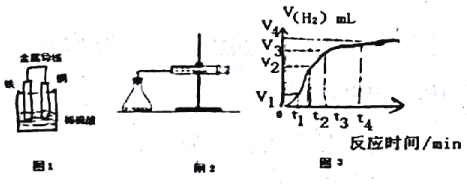
(2)某原电池示意图如图1,则该电池负极电极的反应方程式为_______________。
(3)若该电池反应过程中共有0.3mol电子发生转移,则生成的气体体积在标准状况下的体积是_____L。
(4)为了研究Fe与稀H2SO4反应的速率,某同学通过如图2实验装置测定反应中生成的H2体积,绘制了如图3所示的曲线,在该实验过程中发现锥形瓶温度升高。请回答以下问题。
在0~tl、tl~t2、t2~t3各个时间段里,反应速率最大的时间段是____,产生这种情况可能的原因是_____;该实验过程中收集到气体最多的是在______时间内。
(5)为了减缓该反应的速率,你认为可行的方法是________。
A.向H2SO4溶液中加蒸馏水 B.将Fe片改成Fe粉
C.向H2SO4溶液中加Na2SO4溶液 D.向H2SO4溶液中滴入几滴Cu(NO3)2溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
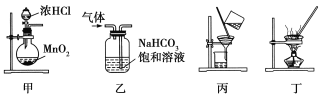
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.SO2能使FeCl3,KMnO4水溶液褪色
B.可以用澄清石灰水鉴别SO2和CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.少量SO2通过浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 通常蔗糖和淀粉都不显还原性
B. 可溶性铜盐可以使蛋白质产生盐析
C. 普通肥皂是油脂经皂化作用制得的
D. 纤维素分子是由葡萄糖单元组成的,可以表现出一些多元醇的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 在多电子的原子里,能量高的电子通常在离核较近的区域内运动
B. 凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构
C. Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O-O共价键
D. 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com