
 如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:
如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:分析 (1)恒温恒压下,通入少量O2能使平衡正向移动并能提高SO2转化率,导致体系中SO2的体积分数减小,若要使SO2的体积分数再变至与原平衡状态A相同,可通入适量SO2,或给体系升温使平衡逆向移动;
(2)依据化学平衡三段式列式计算,设生成三氧化硫物质的量为2x,根据平衡时混合气体总物质的量为2.4mol列式计算得到三氧化硫物质的量;
(3)等压容器中,若起始时a=1.2mol,b=0.6mol,a:b=2:1,等于起始时加入的2mol SO2和1mol O2的量的比值,二者建立的平衡一定为等效平衡;
(4)若原平衡状态A是在恒温恒容下达到的,达到的平衡状态与A相同,按化学计量数完全转化到左边满足n(SO2)=4mol、n(O2)=2mol,要使反应开始时向逆方向进行,则c应大于原平衡时三氧化硫物质的量,若二氧化硫、氧气为0时,可以确定c的最大值.
解答 解:(1)在达到平衡状态A的容器中再通入少量O2,瞬间增大氧气的浓度,能使平衡正向移动并能提高SO2转化率,导致体系中SO2的体积分数减小,若要使SO2的体积分数再变至与原平衡状态A相同,可通入适量SO2,或给体系升温使平衡逆向移动;
故答案为:减小;通入适量SO2;给体系升温;
(2)设反应达到平衡时生成三氧化硫物质的量为2x,
2SO2(g)+O2(g)?2SO3(g),△H<0
起始(mol) 4 2 0
变化(mol) 2x x 2x
平衡(mol) 4-2x 2-x 2x
则:(4-2x)+(2-x)+2x=4.2,
解得:x=1.8mol,即在该平衡状态时n(SO3)=3.6 mol,
故答案为:3.6mol;
(3)等压容器中,若起始时1.2mol SO2、0.6mol O2和x mol SO3,二氧化硫和氧气的物质的量之比是2:1,等于起始时加入的:4mol SO2和2mol O2的量的比值,反应2SO2(g)+O2(g)?2SO3(g)△H<0产物只有三氧化硫,无论三氧化硫的量为多少,利用一边倒的方法,转化为二氧化硫和氧气的量之比均为2:1,二者建立的平衡一定为等效平衡,故达到平衡后各气体的体积分数与平衡状态A相同,
故答案为:任意值;
(4)若原平衡状态A是在恒温恒容下达到的,达到的平衡状态与A相同,按化学计量数完全转化到左边满足n(SO2)=4mol、n(O2)=2mol,要使反应开始时向逆方向进行,则c>3.6,SO2和O2的量均为0,c有值最大时,4molSO2、2molO2完全转化可以得到4molSO3,则起始时n(SO3)的取值范围是:3.6<n(SO3)≤4,
故答案为:3.6<n(SO3)≤4.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的化学计算能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:实验题
(I)检验某溶液中是否含SO42-的正确操作顺序是:取少量未知溶液,加入____________________,若出现 现象,再加入_____________,若出现 现象,证明原溶液含有SO42-;BaSO4和NaCl的悬浊液在分离过程中涉及到过滤、洗涤沉淀操作,证明滤纸上的BaSO4沉淀已经洗净的方法是_______________。
(Ⅱ)现有A、B两种有机物的液体混合物,如果A、B互溶,且相互不发生化学反应。在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题:
(1)分离上述A、B的混合物,常用的方法是 ,需要的玻璃仪器有酒精灯、温度计、牛角管、蒸馏烧瓶,还有 和 (每空1分)。
(2)应用上述分离操作,首先得到的物质是 。
(3)点燃酒精灯前的最近一步操作是 。
(Ⅲ)下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是 mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀硫酸,则需要取 mL的该硫酸。将上述硫酸进行稀释的实验操作为 。
(3)用上述硫酸配制240 mL 4.6 mol·L-1的稀硫酸,实验仪器有:
①50 mL量筒 ②100 mL量筒 ③托盘天平 ④玻璃棒
⑤250 mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶
实验时使用选用仪器的先后顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质的量/mol 时间 | n(N2H4) | N(NO2) | N(N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
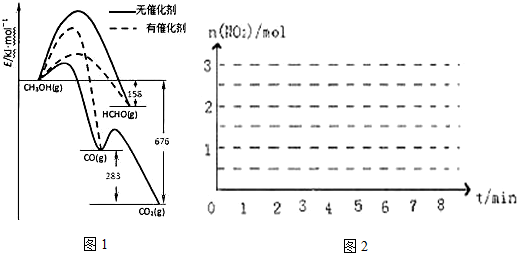
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
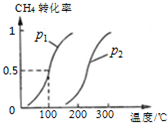 甲烷,甲醇,乙酸是化工产品的重要原料.
甲烷,甲醇,乙酸是化工产品的重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的性质与其成分金属的性质不完全相同 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 黑色的氧化铜灼烧会变成砖红色 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量为44g | B. | 质量为88g/mol | ||
| C. | 有4mol氧原子 | D. | 分子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
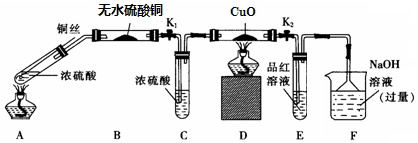
| 硫酸/mol•L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 | |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.
A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.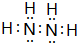 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com