

| ||
| ||


科目:高中化学 来源: 题型:
 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示.下列说法正确的是( )| A、碳棒上发生的主要反应为:2H++2e-=H2↑ |
| B、铝质易拉罐将逐渐得到保护 |
| C、电池总反应为:4Al+3O2+6H2O═4Al(OH)3 |
| D、电子方向为:铝质易拉罐→导线→扬声器→导线→碳棒→浸透食盐水的布 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大,A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1.请回答下列问题:
已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大,A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 材料是人类赖以生存的重要物质基础.铜、镍等金属材料在现代社会中有着重要应用.请回答下列问题:
材料是人类赖以生存的重要物质基础.铜、镍等金属材料在现代社会中有着重要应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
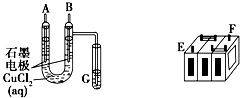 (Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.
(Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH值变小 |
| B、醋酸的电离度增大 |
| C、溶液的导电能力增强 |
| D、中和此溶液所需的0.1mol?L-1 NaOH溶液的体积增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com