
【题目】近年来食品安全问题成为社会各界日益关注的焦点话题.香港地区食环署食物安全中心曾对十五个桂花鱼样本进行化验,结果发现十一个样本中含有孔雀石绿。孔雀石绿是化工产品,具有较高毒性,高残留,且长期服用后,容易致癌、致畸,对人体有害。其结构简式如图所示。下列关于孔雀石绿的说法正确的是( )

A.孔雀石绿的分子式为C23H25N2
B.1mol孔雀石绿在一定条件下最多可与6molH2发生加成反应
C.孔雀石绿属于芳香烃
D.孔雀石绿苯环上的一氯取代物有5种
【答案】D
【解析】
A. 根据结构式确定分子式;
B. 孔雀石绿中含有2个苯环和3个碳碳双键,均可与H2发生加成反应;
C. 含有苯环的烃为芳香烃;
D. 有机物中含有2个苯环,根据结构对称进行分析。
A. 根据结构式可知孔雀石绿的分子式为C23H26N2,A项错误;
B. 孔雀石绿中含有2个苯环和3个碳碳双键,均可与H2发生加成反应,因此1mol孔雀石绿在一定条件下最多可与9molH2发生加成反应,B项错误;
C. 孔雀石绿不是烃,除了C、H两种元素外还含有N,属于芳香族化合物,但不是芳香烃,C项错误;
D. 有机物中含有2个苯环,左下角苯环中含有2种不同环境的氢原子,上方的苯环有3种不同环境的氢原子,因此苯环上的一氯取代物有5种,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】(1)在配制氯化亚铁溶液时要加入一定量的盐酸,目的是______________________;还要加入少量铁粉,目的是_______________________。(以上用相应的离子方程式解释)
(2)把下列溶液蒸干并灼烧,用所得物质的化学式填空:Na2CO3溶液___________; NaClO溶液___________; AlCl3溶液____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为_____________________________。
(2)上述实验说明黑色粉末X中含有_______________________________。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:

(1)操作Z的名称是_________。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为_________。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1B.6C.5D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体 ③调节液面至“0”或“0”刻度线以下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。 请回答:
⑴以上步骤有错误的是(填编号)______,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________
⑵下列选项将导致测定结果偏小的是___________
A.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
B.滴定到终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
⑶判断滴定终点的现象是:__________________________________________________________
⑷下图是某次滴定时的滴定管中的液面,其读数为 ___________mL

⑸根据下列数据:请计算待测盐酸溶液的浓度:__________mol/L
滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①蛋白质 ②油脂 ③葡萄糖 ④纤维素⑤淀粉五种物质中,不能水解的是______(填序号),在人体中不能直接被消化吸收的是________(填序号),蛋白质水解后最终生成__________(填名称),油脂水解后得到醇的结构简式是_________。
(2)某学生设计用如下实验方案用以检验淀粉水解的情况:

由水解液分别进行上述实验后的现象,可得出的实验结论应该是________(填序号)。
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )

A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,并打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,并打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气,并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸,并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(A﹣)>c(K+)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A﹣)+c(HA)<0.1 mol/L
D.实验②反应后的溶液中:c(K+)+c(OH﹣)=c(H+)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备.储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知: H2(g)+A(l)=B(l)ΔH1 O2(g)+B(l)=A(l)+H2O2(l)ΔH2 ,其中A.B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH________0(填“>”.“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收ymol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_________。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
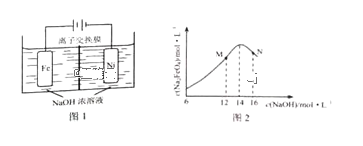
①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com