分析:A.氯离子表示错误,且氯化镁的电子式中两个氯离子分别写在镁离子两边;
B.硫化氢为共价化合物,分子中不存在阴阳离子;
C.甲基中存在3个碳氢共用电子对,碳原子最外层7个电子;
D.氮气的结构式中不需要写出孤电子对.
解答:解:A.氯化镁为离子化合物,氯离子需要标出电荷,且分别写在镁离子两边,正确的电子式为:
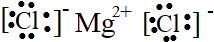
,故A错误;
B.硫化氢为共价化合物,分子中不存在阴阳离子,硫化氢的电子式为:
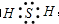
,故B错误;
C.甲基中存在3个碳氢键,碳原子最外层含有7个电子,甲基的电子式为:
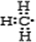
,故C正确;
D.氮气分子存在氮氮三键,结构式中不需要标出氮原子的孤对电子,氮气的结构式为:N≡N,故D错误;
故选C.
点评:本题考查了电子式、结构式的表示方法,题目难度中等,注意掌握电子式、结构式的概念及表示方法,明确离子化合物与共价化合物的电子式的区别.

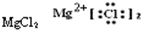

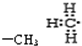

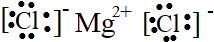 ,故A错误;
,故A错误;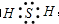 ,故B错误;
,故B错误;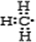 ,故C正确;
,故C正确;
