
【题目】【2016届唐山二模】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8, Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001 mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有 溶液的试管。
乙同学侧定溶液pH
用pH试纸分别测定0.1 mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性。该溶液呈碱性的原因是 (用离子方程式解释)。
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠

已知:① 2NO+ Na2O2 = 2NaNO2 ;
② 酸性条件下,NO和NO2都能与MnO4一反应生成NO3一和Mn2+·
(1)使用铜丝的优点是 。
(2)装置A中反应方程式为 。
装置C 中盛放的药品是 ;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用 。
(3)该小组称取5.000g制取的样品溶于水配成250.0 mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
① 第一次实验数据出现异常,造成这种异常的原因可能是 (填字母代号)。
A.锥形瓶洗净后未干燥
B.酸式滴定管用蒸馏水洗净后未用标准液润洗
C.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为 。
③该样品中亚硝酸钠的质量分数为 。
【答案】(15分) (除标注外其余每空2分)(其它合理答案也给分)
(一)NaCl(1分);NO2-+H2O ![]() HNO2+OH- (2分)
HNO2+OH- (2分)
(二)(1)可以控制反应的发生与停止(1分)
(2)Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (2分) C(2分) 防止水蒸气进入(1分)
(3)① bc 2分)② 6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O (2分)③ 69% (2分)
【解析】
试题分析:(一)由于两种化合物构型相同,开始时离子浓度相同,溶度积常数越小,形成沉淀时需要的Ag+浓度就越小,所以就先形成沉淀,故首先形成的沉淀是AgCl,即NaCl溶液先形成沉淀;NaNO2溶液呈碱性,是由于该盐是强碱弱酸盐,在溶液中NO2-发生水解反应,消耗水电离产生的H+,使水的电离平衡正向移动,当最终达到平衡时,溶液中c(OH-)>c(H+),用离子方程式表示为:NO2-+H2O ![]() HNO2+OH- ;(二)(1)使用铜丝的优点是通过铜丝的下伸或上提使反应发生或停止,反应非常方便;(2)在装置A中铜与浓硝酸发生反应,产生硝酸铜、二氧化氮和水,反应的化学方程式为Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;根据反应原理NO与Na2O2反应产生亚硝酸钠,而在装置A中产生的是NO2气体,所以装置C 中盛放的药品是使NO2反应转化为NO,应该用水,故选项C正确;仪器F中盛有碱石灰,其作用是吸收水分,防止水蒸气进入装置E,影响实验的测定;(3)①A.锥形瓶洗净后未干燥,由于NaNO2的物质的量不变,所以不会影响实验测定结果,错误;B.酸式滴定管用蒸馏水洗净后未用标准液润洗,则会使标准溶液的浓度偏小,导致消耗标准溶液的体积偏大,正确;C.滴定终点时仰视读数,由于滴定管大刻度在下面,使消耗的标准溶液的体积偏大,正确。故正确选项是bc;②酸性KMnO4溶液滴定亚硝酸钠溶液,发生氧化还原反应,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O;③根据数据分析可知第一组数据偏差太大,要舍弃,25.00mL溶液消耗的标准溶液的体积是V(KMnO4) =(20.12+20.00+19.88)mL ÷3=20.00mL,则n(KMnO4)= 0.1000mol/L×0.020L=2.0×10-3mol,根据二者反应的物质的量关系可知:n(NaNO2)=5/2 n(KMnO4)=5/2×n(KMnO4)=5.0×10-3mol,所以该样品中亚硝酸钠的质量分数为(5.0×10-3mol×69g/mol)÷(5.000g÷10)×100%=69%。
HNO2+OH- ;(二)(1)使用铜丝的优点是通过铜丝的下伸或上提使反应发生或停止,反应非常方便;(2)在装置A中铜与浓硝酸发生反应,产生硝酸铜、二氧化氮和水,反应的化学方程式为Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;根据反应原理NO与Na2O2反应产生亚硝酸钠,而在装置A中产生的是NO2气体,所以装置C 中盛放的药品是使NO2反应转化为NO,应该用水,故选项C正确;仪器F中盛有碱石灰,其作用是吸收水分,防止水蒸气进入装置E,影响实验的测定;(3)①A.锥形瓶洗净后未干燥,由于NaNO2的物质的量不变,所以不会影响实验测定结果,错误;B.酸式滴定管用蒸馏水洗净后未用标准液润洗,则会使标准溶液的浓度偏小,导致消耗标准溶液的体积偏大,正确;C.滴定终点时仰视读数,由于滴定管大刻度在下面,使消耗的标准溶液的体积偏大,正确。故正确选项是bc;②酸性KMnO4溶液滴定亚硝酸钠溶液,发生氧化还原反应,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O;③根据数据分析可知第一组数据偏差太大,要舍弃,25.00mL溶液消耗的标准溶液的体积是V(KMnO4) =(20.12+20.00+19.88)mL ÷3=20.00mL,则n(KMnO4)= 0.1000mol/L×0.020L=2.0×10-3mol,根据二者反应的物质的量关系可知:n(NaNO2)=5/2 n(KMnO4)=5/2×n(KMnO4)=5.0×10-3mol,所以该样品中亚硝酸钠的质量分数为(5.0×10-3mol×69g/mol)÷(5.000g÷10)×100%=69%。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】按要求填写除杂试剂及分离提纯的方法(括号中为杂质)
(1)CH4(C2H4):通过盛有 的洗气瓶
(2)乙醇(水):先加 后通过 来加以分离
(3)乙酸乙酯(乙酸):先加 后通过 法加以分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中的化学叙述不正确的是( )
A.无法用米汤(含淀粉)检验加碘盐中的碘酸钾(KIO3)
B.用聚乙烯制造的塑料薄膜可用于包装食品
C.蚕丝、羊毛、棉花的主要成分都是蛋白质
D.75℅的酒精可用于医用消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2![]() 2SO3 ,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3 ,2 min时,测得O2的物质的量为1.6 mol,则:
(1) 2min内,平均反应速率v(O2)= mol/(L·min)
(2)2min时,SO2的浓度为 mol/L
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将![]() 氧化成
氧化成![]() ,而稀硝酸不能氧化
,而稀硝酸不能氧化![]() 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与![]() 反应,能与
反应,能与![]() 反应
反应
![]()
(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论一局的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是 (选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
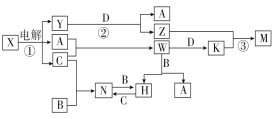
已知:A、B、C、D是单质,其余是化合物。其中B、D是常见金属,且组成B的元素属于过渡元素。又知A在C中点燃有苍白色火焰,M既可溶于盐酸又可溶于NaOH溶液。请回答下列问题:
(1)W的电子式是 。
(2)写出N的化学式 ,并任写一种N的主要用途 。
(3)写出下列反应的离子方程式:
反应① 。
反应③ 。
K溶液和过量氨水反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。
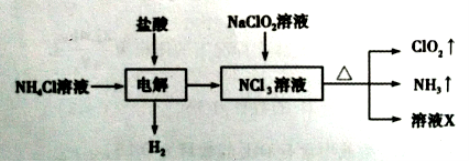
下列说法正确的是( )
A.电解时发生反应的离子方程式为NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B.溶液X中大量存在的阴离子有Cl-、OH-
C.可用饱和食盐水除去ClO2中的NH3
D.可用明矾除去饮用水中残留的NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。

(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
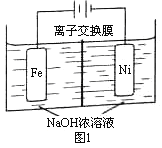

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com