
一定温度时于密封容器中发生反应:mA(g)+nB(g)  pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是( )
pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是( )
A.平衡向正向移动 B.新平衡时,v正(A)=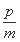 v逆(C)
v逆(C)
C.气体A的转化率升高 D.m+n>p
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(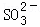 ):n(
):n(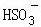 ) 变化的关系如表:
) 变化的关系如表:
| n( | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是( )
|
| A. | NaHSO3溶液中c(H+)<c(OH﹣) |
|
| B. | Na2SO3溶液中c(Na+)>c (SO32﹣)>c(HSO3﹣)>c(OH﹣)>c(H+) |
|
| C. | 当吸收液呈中性时,c(Na+)>c(SO32﹣)>c(HSO3﹣)>c(OH﹣)=c(H+) |
|
| D. | 当吸收液呈中性时,c(Na+)=c(HSO3﹣)+2c(SO32﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在NH3•H2O NH4++OH﹣形成的平衡中,要使NH3•H2O的电离程度及c(OH﹣)都增大,可采取的措施是
NH4++OH﹣形成的平衡中,要使NH3•H2O的电离程度及c(OH﹣)都增大,可采取的措施是
A.通入HCl B.加少量NaOH固体
C.加少量氯化铵固体 D.加热
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 为阿伏加德罗常数的值。下列说法正确的是( )
A.1 L 0.1 mol•L-1的氨水含有0.1NA个OH-
B.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
C.25 ℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA
D.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有物质的量浓度均为0.1 mol·L-1 的① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25 mL,,下列说法正确的是 ( )
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
D.若升高温度,则②的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,20.00 mL硫酸和硝酸的混合溶液,加入足量的氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466 g沉淀。滤液跟2 mol/L NaOH溶液反应,用去10.00 mL碱液时恰好中和。下列说法中正确的是( )
A.原混合液中c(SO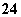 )=0.2 mol/L B.原混合液中c(NO
)=0.2 mol/L B.原混合液中c(NO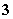 )=0.9 mol/L
)=0.9 mol/L
C.原混合液中pH=0 D.原混合液中由水电离出的c(H+)=0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.0010 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:
2MnO4- +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00 mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中
c(Ca2+)≤1.0×10-5 mol·L-1,应保持溶液中c(C2O42 -)≥ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 (填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量 g/mL(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是________。
①鸡蛋白溶液遇浓硝酸——黄色
②淀粉碘化钾溶液遇碘离子——蓝色
③热的氧化铜遇乙醇——红色
④过氧化钠在空气中久置——淡黄色
(2)有人设计了一套实验室蒸馏石油的五个步骤,请将正确顺序的序号填入括号内。
( )将蒸馏烧瓶固定在铁架台上,在蒸馏烧瓶上塞好带温度计的橡皮塞。
( )连接好冷凝管。把冷凝管固定在铁架台上,将冷凝管下端的橡皮管和自来水龙头连接,将上端的橡皮管放在水槽内。
( )把酒精灯放在铁架台上,根据酒精灯高度确定铁圈的高度,固定铁圈,放好石棉网。
( )向蒸馏烧瓶中放入几片碎瓷片,再用漏斗向烧瓶内加原油,塞好带温度计的橡皮塞,把接收器连接在冷凝器的末端并伸入接收装置(如锥形瓶中)。
( )检查气密性(利用对固定装置微热的方法检查)。
在上述实验中温度计水银球的位置在________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,△H1 >△H2的是
A.C(s)+O2(g)===CO2(g) △H1 C(s)+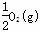 ===CO(g) △H2
===CO(g) △H2
B.S(g)+O2(g)===SO2(g) △H1 S(s)+O2(g)===SO2(g) △H2
C.2H2(g)+O2(g)===2H2O(l) △H1 H2(g)+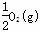 ===H2O(l) △H2
===H2O(l) △H2
D.CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com