
| A. | 氧化性:KMnO4<Cl2 | |
| B. | 500mL12.8mol/L的盐酸与足量的KMnO4反应,可生成1.6 molCl2 | |
| C. | 此反应中氧化剂与还原剂的物质的量之比为1:8 | |
| D. | 实验室使用硫酸而不用盐酸酸化高锰酸钾,因为盐酸会被高锰酸钾氧化 |
分析 A.氧化还原反应中氧化剂氧化性大于氧化产物;
B.2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,结合化学方程式定量关系计算判断;
C.化合价升高元素所在反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
D.稀盐酸被高锰酸钾溶液氧化发生反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;
解答 解:A.反应中高锰酸钾做氧化剂,氧化HCl为Cl2,氧化剂的氧化性大于氧化产物,所以氧化性氧化性:KMnO4>Cl2 ,故A错误;
B.2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,500mL12.8mol/L的盐酸中物质的量=0.5mol×12.8mol/L=6.4mol,与足量的KMnO4反应,16HCl~5Cl2,可生成2 molCl2,故B错误;
C.反应中化合价升高元素是HCl中的氯元素,所以HCl是还原剂,16mol的HCl中只有10mol做还原剂,化合价降低元素是锰元素,所以高锰酸钾是氧化剂,氧化剂与还原剂的物质的量比为1:5,故C错误;
D.实验室使用硫酸而不用盐酸酸化高锰酸钾,因为盐酸会被高锰酸钾氧化,发生反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,故D正确;
故选D.
点评 本题考查学生氧化还原反应的有关知识以及相关计算问题,主要是概念的理解应用和化学方程式的定量计算,要求学生要熟记教材知识,灵活应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
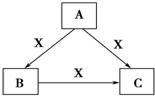 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为硫化氢 | |
| D. | 若X为Cl2,则C可为FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L盐酸溶液中含H+1mol | |
| B. | 常温常压下,1mol CH4的质量为16g/mol | |
| C. | 28gC2H4和C3H6混合气体原子数目为6NA | |
| D. | 标准状况下,2.24 L H2O中所含原子数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.55gCl2通入足量水中充分反应,转移电子数为0.05NA | |
| B. | 18gNH4+含有质子数为10NA | |
| C. | 13.8gNO2与足量水反应时,转移电子的数目为0.2NA | |
| D. | 标准状况下,相同体积的SO3、HCl、NO含有的分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
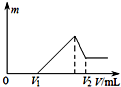
| A. | 24mL | B. | 30mL | C. | 440mL | D. | 44mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Fe3+、K+、Cl-、NO3- | ||
| C. | K+、Ba2+、NO3-、SO42- | D. | Na+、NH4+、Cl-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com