
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 增大压强一定能使化学反应速率加快 |
分析 A、催化剂是影响反应速率的因素,但不是唯一因素;
B、冰箱中温度较低,化学反应速率较慢;
C、加水稀释,硫酸浓度降低;
D、压强只影响有气体参加的化学反应.
解答 解:A、反应物本身的性质是影响反应速率的主要因素,催化剂是影响化学反应速率的主要外界因素,但不唯一,故A错误;
B、食物放在冰箱中会因为温度低,化学反应速率慢而减慢食物变质的速率,故B正确;
C、锌与稀硫酸反应时,加入少量水能够降低氢离子浓度,反应速率减慢,故C错误;
D、压强只影响有气体参加的化学反应,如酸碱中和反应增大压强对反应速率无影响,故D错误;
故选B.
点评 本题考查了影响化学反应速率的因素,题目难度不大,易错点为D,注意压强只影响有气体参加的化学反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有一个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和EO两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷; 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
; ,分子式为C15H22O2;
,分子式为C15H22O2;  中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按以下步骤从
按以下步骤从 合成
合成  .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 、D
、D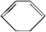 .
.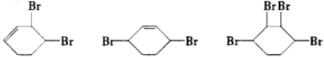 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O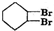 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 18和12 | B. | 6和8 | C. | 11和16 | D. | 12和9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com