
| A. | 增大盐酸的浓度 | B. | 增大压强 | C. | 提高反应的温度 | D. | 用铁粉代替铁片 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-己烯能使KMnO4(H+)溶液褪色 | |
| B. | 汽油、煤油、柴油和植物油都是碳氢化合物 | |
| C. | 乙烯、苯都可与溴水发生加成反应 | |
| D. | 乙烯和聚乙烯都能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 第ⅠA族和第ⅦA族原子化合时,一定生成离子键 | |
| C. | 由非金属元素形成的化合物一定不是离子化合物 | |
| D. | 离子化合物中可能同时含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
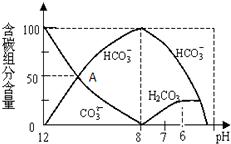 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
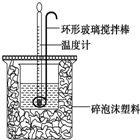 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com