
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
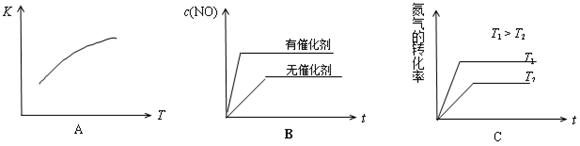
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大、“变小”或“不变)
(1)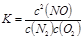 (2)4 % (3)向正反应方向进行;
(2)4 % (3)向正反应方向进行;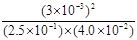 < K
< K
(4)AC(5)不变
解析试题分析:(1)反应平衡常数表达式为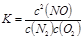 。(2)设消耗c(N2)=x,则平衡时c(N2)=c(O2)=0.5mol/L-x、c(NO)=2x,代入平衡常数表达式得x=0.02,所以N2转化率为4%。(3)此时浓度商Q=(0.001)3/0.25×0.04=0.0009<K,反应向右进行。(4)正反应是吸热反应,温度升高,平衡常数增大,A正确;使用催化剂,反应速率加快,但平衡时c(NO)不变;温度越高,反应速率越快;升高温度,平衡向右移动,N2转化率增大,C正确。(5)向平衡体系中再充一定量的NO,相当于向平衡体系中再充入等物质的量N2和O2,等效于增大压强,增大压强,N2(g) + O2(g)
。(2)设消耗c(N2)=x,则平衡时c(N2)=c(O2)=0.5mol/L-x、c(NO)=2x,代入平衡常数表达式得x=0.02,所以N2转化率为4%。(3)此时浓度商Q=(0.001)3/0.25×0.04=0.0009<K,反应向右进行。(4)正反应是吸热反应,温度升高,平衡常数增大,A正确;使用催化剂,反应速率加快,但平衡时c(NO)不变;温度越高,反应速率越快;升高温度,平衡向右移动,N2转化率增大,C正确。(5)向平衡体系中再充一定量的NO,相当于向平衡体系中再充入等物质的量N2和O2,等效于增大压强,增大压强,N2(g) + O2(g)  2NO(g)平衡不移动,NO体积分数不变。
2NO(g)平衡不移动,NO体积分数不变。
考点:化学平衡常数 转化率 反应反应进行的方向 勒沙特列原理 化学平衡图像 等效平衡
点评:用浓度商判断化学反应进行的方向:若Q=K,则反应是平衡状态;若Q>K,则平衡向左移动;若Q<K,则平衡向右移动。


科目:高中化学 来源: 题型:
 2NO(g)△H>0
2NO(g)△H>0| c2(NO) |
| c(N2)?c(O2) |
| c2(NO) |
| c(N2)?c(O2) |
| (3×10-3 )2 |
| (2.5×10-1)×(4.0×10-2) |
| (3×10-3 )2 |
| (2.5×10-1)×(4.0×10-2) |

查看答案和解析>>
科目:高中化学 来源:2012届江西省红色六校高三第一次联考化学试卷 题型:填空题
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志 。
| A.消耗1molN2同时生成1molO2 | B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 | D.2V(N2)正=V(NO)逆 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省高三第五次模拟化学试卷(解析版) 题型:填空题
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大、“变小”或“不变)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省红色六校高三第一次联考化学试卷 题型:填空题
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志 。
A.消耗1molN2同时生成1molO2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2V(N2)正=V(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com