
分析 (1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)根据Fe原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时,先失去4s上的电子后失去3d上的电子,硫氰化铁为血红色;
(3)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;乙酸分子间可形成氢键导致沸点较高;根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占$\frac{1}{2}$,通过一个顶点可形成8个晶胞.
解答 解:(1)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,
故答案为:X射线衍射;
(2)26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,失去电子变为铁离子时,先失去4s上的2个电子后失去3d上的1个电子,因此Fe3+的电子排布式为1s22s22p63s23p63d5,硫氰化铁为血红色,
故答案为:4;1s22s22p63s23p63d5;血红色;
(3)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛,该晶胞中O原子数为4×1+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个,
故答案为:sp3、sp2;形成了分子间的氢键,造成沸点升高;16;
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占$\frac{1}{2}$,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×$\frac{1}{2}$=12;一个晶胞中Al原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,因此Al的密度ρ=$\frac{m}{V}$=$\frac{4×27g}{{N}_{A}×(0.405×1{0}^{-7}cm)^{3}}$=$\frac{4×27}{{N}_{A}×(0.405×1{0}^{-7})^{3}}$g•cm-3,
故答案为:12,$\frac{4×27}{{N}_{A}×(0.405×1{0}^{-7})^{3}}$.
点评 本题考查了晶体的性质、原子核外电子排布规律、氢键、杂化类型、晶胞配位数及密度的计算,综合性非常强,为历年高考选作常考题型,难度中等,其中晶胞配位数以及密度的计算是本题的难点.


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
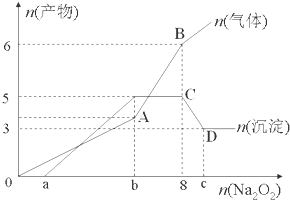
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L 水中含有的分子数为0.5NA | |
| B. | 标准状况下,22.4LN2中含有的原子数为NA | |
| C. | 23g Na与足量H2O反应转移的电子数为NA | |
| D. | 物质的量浓度为1 mol•Lˉ1的K2SO4溶液中,含2 NA个K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
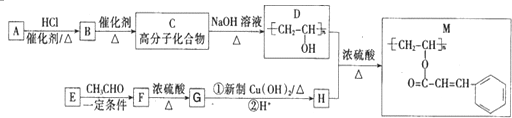
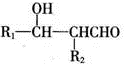
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Fe2+、NO3-、HCO3- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | K+、AlO2-、Cl-、SO42- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Ba(OH)2溶液中,c(Ba2+)=2c(OH-) | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 在难溶电解质的饱和溶液中,电解质的Ksp越小,其物质的量浓度越小 | |
| D. | 反应5S2O82-+2Mn2++8H20═10SO42-+2MnO4-+16H+,得电子的元素是氧元素,反应中转移10e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com