
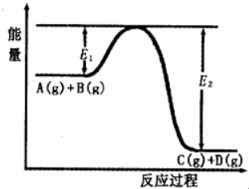
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.分析 (1)根据反应物与生成物总能量大小判断;
(2)加入催化剂能降低反应所需的活化能;
(3)催化剂不改变反应物总能量与生成物总能量之差即反应热不变;
(4)反应热△H=反应物的活化能-生成物的活化能;
解答 解:(1)由反应过程中的能量变化图可知,反应物的总能量高于生成物的总能量,故反应为放热反应;
故答案为:放热;
(2)加入催化剂能降低反应所需的活化能,则E1和E2都减小;
故答案为:减小;减小;
(3)加入催化剂改变了反应的途径,降低反应所需的活化能,但反应热取决于反应物总能量与生成物总能量之差,与催化剂的使用无关;
故答案为:否;只降低反应所需活化能,不改变反应物、生成物总能量,所以反应热不变;
(4)反应热△H=反应物的活化能-生成物的活化能=E1-E2,
故答案为:E1-E2.
点评 本题考查反应热的判断,影响化学反应速率和平衡的因素,难度适中,注意催化剂对反应热无影响.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氯化铝溶液与过量氨水反应:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | O-H |
| 能量(kJ) | 436 | a | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=2K2 | B. | K1=K2 | C. | K1=$\frac{1}{{{K}_{2}}^{2}}$ | D. | K1=$\frac{1}{2{K}_{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越长 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | H+浓度相同的盐酸和硫酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
| D | 在容积可变的密闭容器中发生反应H2(g)+I2(g)?2HI(g),把容积缩小一倍 | 反应速率不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com