
【题目】I.短周期元素X、Y、Z、R在周期表中的相对位置如图所示,请回答以下问题:

(1)X的原子结构示意图为________,其在周期表中的位置为_______________。
(2)Y与Z的原子半径大小关系是:Y____Z (填“>”或“<”)。
(3)X与R的非金属性强弱顺序是:X____R (填“>”或“<”)。
(4)位于Y下一周期的同主族元素的最高价氧化物对应的水化物的化学式为______。
II.研究表明,在高压与加热的条件下,钠、氦、氧三种元素能形成一种结构特殊的固态化合物Na2HeO。
(1)化合物Na2HeO中氦元素的化合价为0,其中氧元素的化合价为______。
(2)钠、氦气、氧气反应生成Na2HeO的化学方程式为_____________。
【答案】 第二周期VIA族 > > KOH -2 4 Na + 2He + O2 = 2Na2HeO
第二周期VIA族 > > KOH -2 4 Na + 2He + O2 = 2Na2HeO
【解析】
由元素在周期表中的位罟可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,以此解答。
(1)由X为O元素,核内由8个质子,X的原子结构示意图为 ,其在周期表中的位置为第二周期VIA族。答案:
,其在周期表中的位置为第二周期VIA族。答案: ;第二周期VIA族。
;第二周期VIA族。
(2)由Y为Na元素,Z为Al元素,它们在同一周期,从左到右半径逐渐减小,所以Y的原子半径大于Z的原子半径即Y>Z。答案:>。
(3)X为O元素, R为S元素,它们属于同一主族,由上到下非金属性逐渐减弱,所以X的非金属性比R的强即X>R 答案:>。
(4)Y为Na元素,位于Na的下一个周期的同主族元素为K元素,钾的最高价氧化物対应的水化物的化学式为KOH;答案为:KOH。
II.钠、氦、氧三种元素能形成一种结构特殊的固态化合物Na2HeO。
(1)根据化学式各元素化合价代数和为零可知:化合物Na2HeO中氦元素的化合价为0,Na元素的化合价为+1,所以氧元素的化合价为-2。答案:-2。
(2)钠、氦气、氧气反应生成Na2HeO的化学方程式为4Na + 2He + O2 = 2Na2HeO;答案:4Na + 2He + O2 = 2Na2HeO。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列各组反应,前后均可以用同一个离子方程式表示的是
A.HCl+Na2CO3 HCl+NaHCO3
B.HCl+Na2CO3 H2SO4+K2CO3
C.H2S+NaOH H2SO4+KOH
D.BaCl2+Na2SO4 BaCO3+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是
A.③②⑤①④B.①②③⑤④C.②③①⑤④D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学设计实验探究碳、硅元素的非金属性的相对强弱,实验装置如图。根据要求完成下列各题。
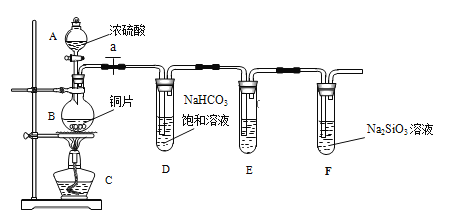
(1)填写所示仪器名称:A__________,B__________。
(2)实验步骤:连接仪器、______________、加药品后,打开 a、滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中装的是酸性KMnO4溶液,其作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com