

分析 A、B、C、D、E为短周期主族元素,原子序数依次增大,A为半径最小的元素,则A为H元素;B的一种核素常用于文物鉴定,则B为碳元素;化合物BC与N2互为等电子体,则C为O元素;D的氢化物有臭鸡蛋气味,则D为S元素,可推知E为Cl;F位于第四周期IB族,则F为Cu,据此解答.
解答 解:A、B、C、D、E为短周期主族元素,原子序数依次增大,A为半径最小的元素,则A为H元素;B的一种核素常用于文物鉴定,则B为碳元素;化合物BC与N2互为等电子体,则C为O元素;D的氢化物有臭鸡蛋气味,则D为S元素,可推知E为Cl;F位于第四周期IB族,则F为Cu.
(1)Cl-的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)实验室制取C2H2的化学反应方程式:CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(3)将O2通入FeSO4的离子方程式:4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(4)H2S、H2O均属于分子晶体,但H2O分子之间存在氢键,其沸点高于H2S的,
故答案为:H2O的沸点较高;H2S、H2O均属于分子晶体,但H2O分子之间存在氢键;
(5)氯气与C2H6反应生成一取代物CH3CH2Cl,检验取代物中的Cl元素:CH3CH2Cl在氢氧化钠水溶液、加热条件下发生水解反应,然后加入硝酸酸化,再滴加硝酸银溶液,有白色沉淀产生,
故答案为:CH3CH2Cl在氢氧化钠水溶液、加热条件下发生水解反应,然后加入硝酸酸化,再滴加硝酸银溶液,有白色沉淀产生;
(6)Cu晶胞为面心立方最密堆积,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×64}{{N}_{A}}$g,晶胞密度为a g/cm3、边长b pm,则(b×10-10 cm)3×a g/cm3=$\frac{4×64}{{N}_{A}}$g,故NA=$\frac{4×64}{a×(b×1{0}^{-10})^{3}}$,
故答案为:$\frac{4×64}{a×(b×1{0}^{-10})^{3}}$.
点评 本题考查结构性质位置关系应用,需要学生具备扎实的基础,(6)中注意识记常见金属晶体的堆积方式.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 组成元素相同,分子结构不同 | |
| B. | 组成元素的质量分数相同,只有化学性质不同 | |
| C. | 具有相同分子量而结构不同 | |
| D. | 具有相同分子量,且组成元素及组成元素的质量分数相同,只是结构不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
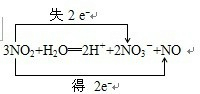 .
.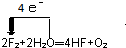 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 部分结构知识 | 部分性质 | |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3 (n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com