
分析 (1)金属性越强,对应最高价氧化物的碱性就越强,故可用Na、Mg跟水反应的剧烈程度来推断NaOH的碱性比Mg(OH) 2的碱性强,也可根据“强酸制弱酸,强碱制弱碱”的道理,实现由NaOH制Mg(OH) 2来证明;
(2)非金属性越强最高价氧化物对应水化物的酸性越强;
(3)Cl2能置换出Br2,说明Cl的非金属性比Br强,可推知其氢化物的稳定性比溴化氢强.
解答 解:(1)金属性越强,对应最高价氧化物的碱性就越强,故可用Na、Mg跟水反应的剧烈程度来推断NaOH的碱性比Mg(OH) 2的碱性强,也可根据“强酸制弱酸,强碱制弱碱”的道理,实现由NaOH制Mg(OH) 2来证明,即往MgCl 2溶液中滴加NaOH溶液产生Mg(OH) 2沉淀,则可证明,MgCl 2+2NaOH═Mg(OH)2↓+2NaCl,
故答案为:MgCl 2+2NaOH═Mg(OH)2↓+2NaCl;
(2)由H2SO4制备H2CO 3可说明硫酸酸性强于碳酸,进而推知硫的非金属性比碳强,如H2SO4+Na2CO 3=Na2SO4+CO2↑+H2O,
故答案为:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;
(3)Cl2能置换出Br2,说明Cl的非金属性比Br强,可推知其氢化物的稳定性比溴化氢强,反应方程式为:Cl2+2NaBr═2NaCl+Br2,故答案为:Cl2+2NaBr═2NaCl+Br2.
点评 本题考查非金属强弱的比较方法,学生应注重非金属性比较方法的归纳来解答,尤其要熟悉常用的比较方法(非金属单质之间的置换反应、气态氢化物的稳定性、最高价含氧酸的酸性),难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1氨水中c$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,则c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 在0.1 mol•L-1(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)] | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 新鲜肉 | 次鲜肉 | 变质肉 | |
| pH | 5.8-6.2 | 6.3-6.6 | 6.7以上 |
| A. | 不变 | B. | 变强 | C. | 变弱 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
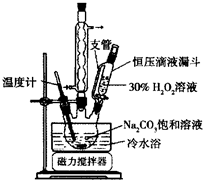 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红磷又接触到氧气 | |
| B. | 红磷的温度还高于它的着火点 | |
| C. | 燃烧时红磷转变成白磷,降低了着火点 | |
| D. | 瓶内的氧气不能耗尽红磷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
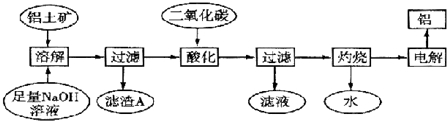
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 燃放烟花炮竹会加剧“雾霾”的形成,当“雾霾”中粉尘颗粒直径小于2.5 μm时,可能发生丁达尔效应 | |
| C. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 | |
| D. | 光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉和稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 稀硫酸和Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | CuSO4和NaOH溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| D. | 单质铜和AgNO3溶液反应:Cu+2Ag+═Cu2++2Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com