
分别将下列物质:①FeCl3②CaO③NaCl④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是( )
A.②③ B.③⑥ C.①④ D.⑤⑥
科目:高中化学 来源: 题型:
最近发现一种新微粒O4,有关这种新微粒的说法正确的是
A.它的结构与P4相同 B.它的摩尔质量为64
C.它是氧气的同素异形体 D.它是由两个氧分子通过分子间作用力结合而成的新微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
从原料和环境方面的要求看,绿色化学对生产中的化学反应提出一个提高原子利用率
的要求,即尽可能不采用那些对产品的化学组成来说没有必要的原料。现有下列3种
合成苯酚的反应路线:

其中符合原子节约要求的生产过程是( )
A.③ B.② C.① D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有下列物质 ①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤H2O
⑥熔融NaCl ⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度
c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③ a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.放热反应都是自发的,吸热反应都非自发
B.熵增大反应不一定自发,但自发反应熵一定增大
C.判断反应进行的方向,应综合考虑体系的焓变和熵变
D.自发反应是不可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
①福岛核电站泄漏的放射性物质含的 和
和 是互为同位素,化学性质几乎相同
是互为同位素,化学性质几乎相同
②大量燃烧化石燃料排放的废气中含大量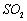 ,造成大气污染,从而使雨水的
,造成大气污染,从而使雨水的 ,形成酸雨
,形成酸雨
③大量排放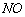 和
和 等氮氧化物是形成光化学烟雾和酸雨的一个重要原因
等氮氧化物是形成光化学烟雾和酸雨的一个重要原因
④高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
⑤在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量
⑥石灰抹墙的硬化原理水泥砌墙的硬化原理相同
⑦SO2有漂白性,所以SO2可使溴水褪色
A.④⑤ B.①⑥⑦ C.①②③ D.②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)研究硫及其化合物性质有重要意义。
 硫酸工业生产中涉及如下反应:
硫酸工业生产中涉及如下反应:
2SO2(g)+O2(g) 2SO3(g)。向2L的容器中充入
2SO3(g)。向2L的容器中充入
2molSO2、1molO2,SO2的平衡转化率与温度的关系
如右图所示。
T1温度时反应进行到状态D时,v(正) v(逆)
(填“>”、“<”或“=”)。
温度为T1时,反应的平衡常数K= 。(单位必须写)
若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍 b. Q2一定等于Q1
c. 新平衡时SO2的转化率一定大于80% d. T3时的平衡常数大于T1时的平衡常数
(2)已知:25°C时,Ksp[Mg(OH)2]=5.6×10-12 Ksp(MgF2)=7.4×10-11 。25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变);
在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
(3)Al2(SO4)3溶液显示酸性,其原因是 (写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因: 。
(4)加热蒸发下列溶液,能析出得到原溶质的是
a. KNO3溶液 b. AlCl3溶液 c. Al2(SO4)3溶液 d.盐酸
(5)25°C时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+ 浓度之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com