
分析 由不同非金属元素形成的化学键为极性键;由同种非金属元素形成的化学键为非极性键;只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子;极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
解答 解:HF中含有极性键,正负电荷的中心不重合,属于极性分子,分子极性最大;
H2O中含有极性键,空间结构为折线型,属于极性分子;
NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子;
CH4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子;
N2中只含非极性键,属于非极性分子;
CO2含有极性键,空间结构为直线型,属于非极性分子;
HI中含有极性键,正负电荷的中心不重合,属于极性分子;
故答案为:N2;CH4;NH3;H2O;HF.
点评 本题考查极性键和非极性键,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的关系来分析解答即可,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
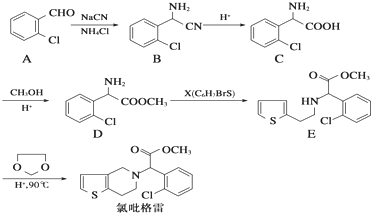 ,
, .
.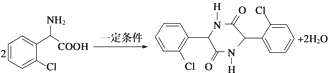 .
.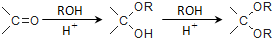 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物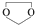 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物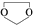 的最后一步反应
的最后一步反应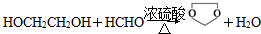 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量CO2与NaOH溶液反应:CO2+2OH-=CO32-+H2O | |
| B. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
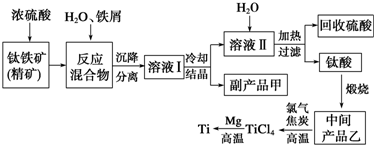
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
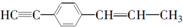 的说法中正确的是( )
的说法中正确的是( )| A. | 有7个碳原子可能在同一直线上 | |
| B. | 只可能有5个碳原子在同一直线上 | |
| C. | 最多只可能有9个碳原子在同一平面上 | |
| D. | 所有原子都可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅晶体的分子式:SiO2 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | F-离子结构示意图: | D. | 四氯化碳的电子式: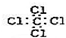 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、OH-、SO42- | B. | NH4+、Mg2+、NO3-、Cl- | ||
| C. | Ba2+、OH-、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com