
| A、加少量稀硫酸 |
| B、加少量的氯化钠溶液 |
| C、加蒸馏水 |
| D、加少量硫酸铜 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、K+、Cl-、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、H+、K+、Fe2+、NO3- |
| D、I-、Cl-、H+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| B、Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
| C、电解精炼铜时,阳极质量每减少32g,阴极析出的铜质量也为32g |
| D、用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:1 |
| C、4:1 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、pH=2的盐酸与pH=12的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| C、pH=11的Na2CO3溶液中:c(Na+)-2c(CO32-)-c(HCO3-)=10-3-10-11 |
| D、浓度分别为0.1mol?L-1和0.01mol?L-1的CH3COOH溶液中:c(CH3COO-)前者为后者的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6mol?L-1 |
| B、0.15mol?L-1 |
| C、0.3mol?L-1 |
| D、0.45mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
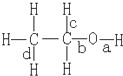 乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂位置分别是:
乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂位置分别是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com