
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L 0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA |
分析 A、求出镁的物质的量,然后根据反应后镁变为+2价来分析;
B、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2mol氧原子来分析;
C、根据氢原子个数求出甲醇的分子个数,然后根据1个甲醇分子中含5条σ键来分析;
D、醋酸是弱电解质,不能完全电离.
解答 解:A、2.4g镁的物质的量为0.1mol,而反应后镁变为+2价,故0.1mol镁反应后失去0.2NA个电子,故A错误;
B、标况下5.6L二氧化碳的物质的量为0.25mol,而1mol二氧化碳中含2mol氧原子,故0.25mol二氧化碳中含0.5NA个氧原子,故B正确;
C、氢原子个数为0.4NA,而1个甲醇分子中含4个H,故甲醇的分子个数为0.1NA个,而1个甲醇分子中含5条σ键,故0.1NA个甲醇分子中含0.5NA条σ键,故C错误;
D、醋酸是弱电解质,不能完全电离,故溶液中的氢离子的个数小于0.05NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:推断题
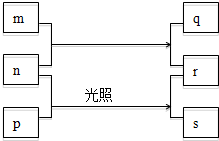 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的化合物,且这几种化合物中每种都由2种元素组成.n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一种一元强酸,s通常为难溶于水的混合物.上述物质的转化关系如图所示.
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的化合物,且这几种化合物中每种都由2种元素组成.n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一种一元强酸,s通常为难溶于水的混合物.上述物质的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数为NA的CO、C2H4混合气体体积为22.4L,质量为28g | |
| B. | 标准状况下,2.24 L Cl2溶于水得新制氯水,该过程中转移的电子数目为0.1NA | |
| C. | 物质的量均为1 mol的过氧化钠和氧化钠中阴离子个数均为NA | |
| D. | 0.1 mol•L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、Al3+、Cl-、NO3- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 在澄清透明的溶液中:Cu2+、K+、SO42-、Cl- | |
| D. | 在能使甲基橙变黄色的溶液中:Na+、CO32-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | C2H4+3O2$\stackrel{点燃}{→}$2CO2+2H2O | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③⑥ | C. | ②④ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
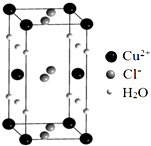 将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4•H2O•SO42-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4•H2O•SO42-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
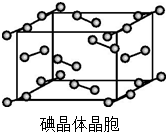 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.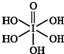 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”“<”或“=”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com